
第2章 化学键 化学反应规律——【期末复习】高一化学单元复习知识点梳理(鲁科版2019必修第二册)
展开第二章 化学键 化学反应规律知识清单
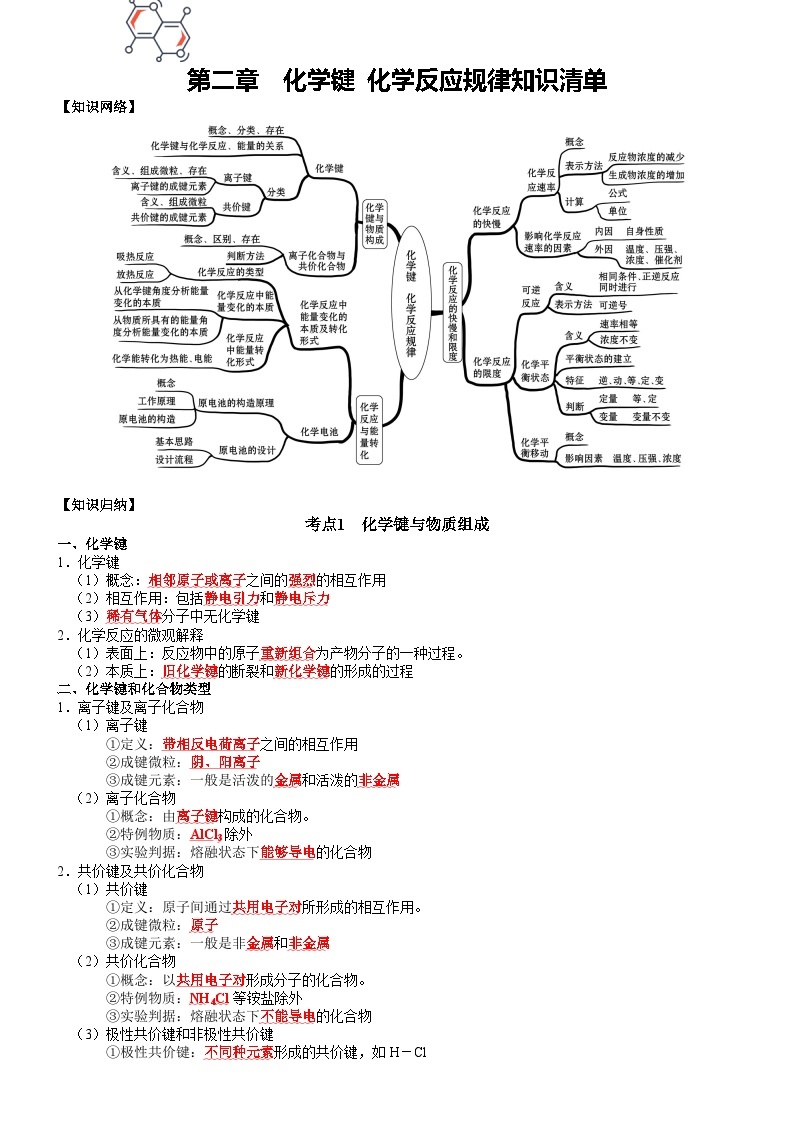
【知识网络】
【知识归纳】
考点1 化学键与物质组成
一、化学键
1.化学键
(1)概念:相邻原子或离子之间的强烈的相互作用
(2)相互作用:包括静电引力和静电斥力
(3)稀有气体分子中无化学键
2.化学反应的微观解释
(1)表面上:反应物中的原子重新组合为产物分子的一种过程。
(2)本质上:旧化学键的断裂和新化学键的形成的过程
二、化学键和化合物类型
1.离子键及离子化合物
(1)离子键
①定义:带相反电荷离子之间的相互作用
②成键微粒:阴、阳离子
③成键元素:一般是活泼的金属和活泼的非金属
(2)离子化合物
①概念:由离子键构成的化合物。
②特例物质:AlCl3除外
③实验判据:熔融状态下能够导电的化合物
2.共价键及共价化合物
(1)共价键
①定义:原子间通过共用电子对所形成的相互作用。
②成键微粒:原子
③成键元素:一般是非金属和非金属
(2)共价化合物
①概念:以共用电子对形成分子的化合物。
②特例物质:NH4Cl等铵盐除外
③实验判据:熔融状态下不能导电的化合物
(3)极性共价键和非极性共价键
①极性共价键:不同种元素形成的共价键,如H-Cl
②非极性共价键:同种元素形成的共价键,如H-H
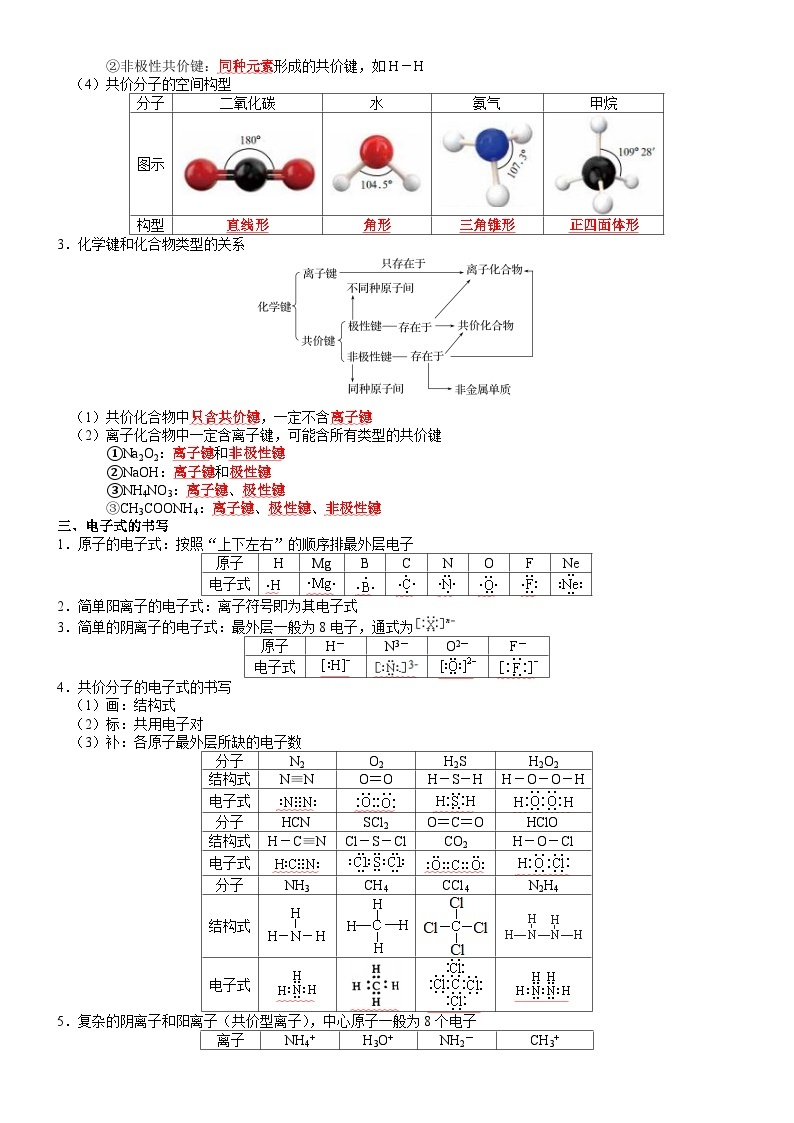
(4)共价分子的空间构型
分子
二氧化碳
水
氨气
甲烷
图示
构型
直线形
角形
三角锥形
正四面体形
3.化学键和化合物类型的关系
(1)共价化合物中只含共价键,一定不含离子键
(2)离子化合物中一定含离子键,可能含所有类型的共价键
①Na2O2:离子键和非极性键
②NaOH:离子键和极性键
③NH4NO3:离子键、极性键
③CH3COONH4:离子键、极性键、非极性键
三、电子式的书写
1.原子的电子式:按照“上下左右”的顺序排最外层电子
原子
H
Mg
B
C
N
O
F
Ne
电子式
2.简单阳离子的电子式:离子符号即为其电子式
3.简单的阴离子的电子式:最外层一般为8电子,通式为
原子
H-
N3-
O2-
F-
电子式
4.共价分子的电子式的书写
(1)画:结构式
(2)标:共用电子对
(3)补:各原子最外层所缺的电子数
分子
N2
O2
H2S
H2O2
结构式
N≡N
O=O
H-S-H
H-O-O-H
电子式
分子
HCN
SCl2
O=C=O
HClO
结构式
H-C≡N
Cl-S-Cl
CO2
H-O-Cl
电子式
分子
NH3
CH4
CCl4
N2H4
结构式
电子式
5.复杂的阴离子和阳离子(共价型离子),中心原子一般为8个电子
离子
NH4+
H3O+
NH2-
CH3+
电子式
离子
OH-
O22-
CN-
C22-
电子式
[]2-
6.离子化合物的电子式:阴阳离子交替排列,不可合并
离子
Na2O
MgCl2
Na2O2
KHS
电子式
离子
NaOH
Na3N
NH4Cl
NaClO
电子式
7.用电子式表示化合物的形成过程
(1)离子化合物的形成
①表现形式:原子的电子式→离子化合物的电子式
②电子得失:用弯箭头表示电子的得失
③实例:
(2)共价键化合物的形成
①表现形式:原子的电子式→共价化合物的电子式
②电子得失:不用画弯箭头表示
③实例
考点2 化学反应与能量转化
一、放热反应和吸热反应
1.前提条件:必须是化学反应
(1)物质的溶解过程:主要发生物理变化
①放热过程:浓硫酸、NaOH固体溶于水
②吸热过程:NH4NO3固体溶于水
(2)状态变化:发生物理变化
①放热过程:凝固、液化、凝华等
②吸热过程:升华、汽化、熔化等
(3)化学键的变化
①放热过程:化学键的形成过程,如2H→H2,Na++Cl-=NaCl
②吸热过程:化学键的断裂过程,如H2→2H,NaCl=Na++Cl-
2.本质判据
(1)能量角度
①放热反应:反应物的能量总和>生成物的能量总和
②吸热反应:反应物的能量总和<生成物的能量总和
(2)键能角度
①放热反应:反应物的键能总和<生成物的键能总和
②吸热反应:反应物的键能总和>生成物的键能总和
3.条件判据
(1)需要持续加热才能进行的反应一般是吸热反应
(2)反应开始需要加热,停热后仍能继续进行,一般是放热反应
4.现象判据
(1)反应体系的温度变化
①体系的温度升高:放热反应
②体系的温度降低:吸热反应
(2)密闭体系的压强变化
①体系的压强增大:放热反应
②体系的压强减小:吸热反应
(3)液体的挥发程度
①液体的挥发程度增大:放热反应
②液体的挥发程度减小:吸热反应
(4)催化剂的红热程度
①停热后催化剂继续红热:放热反应
②停热后催化剂不再红热:吸热反应
4.经验判据
(1)放热反应
①金属和金属氧化物与酸或水的反应
②可燃物的燃烧反应及缓慢氧化
③酸和碱的中和反应
④铝热反应,如2Al+Fe2O32Fe+Al2O3
⑤大多数的化合反应。如2NO2N2O4
(2)吸热反应
①大多数的分解的反应(2H2O22H2O+O2↑除外)
②铵盐和碱反应,如Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3•H2O+8H2O
③碳酸氢钠与柠檬酸的反应
④两个特殊反应:C+CO22CO、C+H2O(g)CO+H2
5.注意事项
(1)反应的热效应与反应条件无必然关系
①在高温下才能进行的化学反应不一定是吸热反应
②在常温下进行的化学反应不一定是放热反应
③使用催化剂的反应不一定是吸热反应
(2)反应的热效应与反应是化合还是分解无必然关系
①化合反应不一定是放热反应
②分解反应不一定是吸热反应
6.根据键能计算反应热
(1)断键:E吸=反应物的键能和
(2)成键:E放=生成物的键能和
(3)Q吸=E吸-E放=反应物的键能和-生成物的键能和
(4)Q放=E放-E吸=生成物的键能和-反应物的键能和
二、反应过程中热量大小的比较
1.燃烧过程中热量大小的比较
(1)物质完全燃烧时放出的热量多
(2)物质在O2中完全燃烧放出的热量比在空气中的少(光能多)
(3)物质完全燃烧生成固态产物时放出的热量最多
(4)气态的物质完全燃烧放出的热量最多
2.金属性和非金属性的强弱与能量的关系
(1)金属性越强,越容易失电子,吸收的能量越少
(2)非金属性越强,越容易得电子,释放的能量越多
(3)非金属单质与H2化合时生成的气态氢化物越稳定,放出的能量越多
3.根据稳定性判断能量高低
(1)微粒稳定性的判断
①能量角度:微粒所含的能量越低越稳定
②键能角度:微粒所含的化学键键能越大越稳定
(2)生成稳定性强的物质,放热多
考点3 化学电源
一、原电池的原理
1.能量转化:化学能能转化为电能
2.反应要求
①前提要求:自发反应
②本质要求:氧化还原反应
③能量要求:放热反应
3.装置的构成条件
(1)两个活泼性不同的电极
①负极:一般是较活泼的金属材料
②正极:比负极不活泼的金属或石墨
(2)有电解质(酸、碱、盐)溶液或熔融的电解质
(3)闭合回路:两个电极用导线连接或直接接触
4.电极反应
(1)负极:还原剂发生价升高的氧化反应
(2)正极:氧化剂发生价降低的还原反应
(3)电池
①本质反应:还原剂和氧化剂的反应
②一般规律:电解质溶液和负极材料的反应
5.三个方向
(1)电子流向:负极正极
(2)电流流向:正极负极正极
(3)离子流向:阳离子→正极,阴离子→负极
6.盐桥式原电池
(1)盐桥作用
①导电:盐桥中离子的定向迁移构成了电流通路;
②平衡电荷:使由它连接的两溶液保持电中性;
③隔离:使相互反应的物质不接触。
(2)离子迁移方向:阳离子→正极;阴离子→负极
7.几种特殊的电池
(1)太阳能电池
①能量转化:太阳能→电能
②转化材料:晶体硅
(2)燃料电池
①可燃物(还原剂,如氢气):作负极
②助燃物(氧化剂,如氧气):作正极
二、影响原电池电极极性的因素
1.影响因素
(1)金属的活动性:一般是活泼金属为负极
(2)电解质溶液的酸碱性及氧化性等因素
2.判断方法
(1)能够和电解质溶液反应的电极为负极
(2)容易和电解质溶液反应的电极为负极
①Mg‖稀硫酸‖Al形成的原电池,Mg是负极
②Mg‖氢氧化钠溶液‖Al形成的原电池,Al是负极
③Fe‖稀硝酸‖Cu形成的原电池,Fe是负极
④Fe‖浓硝酸‖Cu形成的原电池,Cu是负极
3.根据电极材料判断正负极
(1)金属单质和非金属形成的电池,金属单质为负极
(2)金属单质和化合物形成的电池,金属单质为负极
(3)电极材料相同的原电池,还原剂为负极
4.根据反应现象判断正负极
(1)质量减小的是负极,质量增加的是正极
(2)有气泡产生的电极是正极
三、原电池原理的应用
1.加快氧化还原反应速率
(1)向反应中加入少量不活泼金属的盐溶液
(2)一般不纯的金属比纯金属腐蚀速率快
2.比较金属的活泼性:一般负极活泼
3.设计原电池
(1)分析原电池反应,判断正负极和电解质溶液
(2)盐桥式原电池:相互反应的电极和溶液通过盐桥隔离开
4.判断金属腐蚀的快慢
(1)原电池腐蚀>化学腐蚀>有防护的腐蚀
(2)活泼性不同的金属,活泼性差别越大,腐蚀速率越快
(3)对于同一金属:离子浓度大>离子浓度小>非电解质溶液
四、原电池电极反应式书写方法
1.典型溶液中的原电池:
(1)书写规则
①电池反应:负极和电解质溶液反应
②负极反应:参与反应金属失电子变成金属阳离子
③正极反应:溶液中的阳离子得电子变成金属或低价阳离子
(2)Zn‖稀硫酸‖Cu
①电池反应:Zn+2H+Zn2++H2↑
②负极反应:Zn-2e-Zn2+
③正极反应:2H++2e-H2↑
(3)Ag‖硝酸银溶液‖Fe
①电池反应:Fe+2Ag+Fe2++2Ag
②负极反应:Fe-2e-Fe2+
③正极反应:Ag++e-Ag
(4)C‖氯化铁溶液‖Cu
①电池反应:Cu+2Fe3+Cu2++2Fe2+
②负极反应:Cu-2e-Cu2+
③正极反应:Fe3++e-Fe2+
2.根据电池反应写电极反应式:用溶液中的离子补充电荷
(1)Mg‖氢氧化钠溶液‖Al
①电池反应:2Al+2NaOH+6H2O2Na[Al(OH)4]+3H2↑
②负极反应:Al+4OH--3e-[Al(OH)4]-
③正极反应:2H2O+2e-H2↑+2OH-
(2)锌锰酸性干电池(Zn、MnO2、NH4Cl、C)
①电池反应:Zn+2NH4Cl+MnO2=ZnCl2+2NH3+MnO+H2O
②负极反应:Zn-2e-Zn2+
③正极反应:MnO2+2e-+2NH4+MnO+2NH3+H2O
(3)锌锰碱性干电池(Zn‖KOH溶液‖MnO2)
①电池反应:Zn+H2O+2MnO2=Zn(OH)2+Mn2O3
②负极反应:Zn-2e-+2OH-Zn(OH)2↓
③正极反应:2MnO2+2e-+H2OMn2O3+2OH-
(4)银-锌电池(Zn‖KOH溶液‖Ag2O)
①电池反应:Zn+Ag2O=ZnO+2Ag
②负极反应:Zn+2OH--2e-=ZnO+H2O
③正极反应:Ag2O+H2O+2e-=2Ag++2OH-
考点4 化学反应的快慢
一、化学反应速率
1.概念:用来衡量化学反应进行快慢的物理量
2.表示方法:单位时间内反应物浓度的减少或生成物浓度的增加
3.计算公式:v==
(1)常用单位:mol·L-1·s-1或mol·L-1·min-1或mol·L-1·h-1
(2)适用范围
①表示气体物质或溶液中可溶性物质的速率
②不表示固体或纯液体物质的速率
(3)说明
①化学反应速率表示某段时间内的平均反应速率,不表示即时速率
②化学反应速率只有正值,没有负值
③固体或纯液体也有反应速率,只不过不能用该方法表示
④随着反应的进行,反应物的浓度逐渐减小,反应速率越来越慢
4.利用关系式计算
(1)应用前提:同一化学反应
(2)常用关系:速率比=化学计量数比=物质的量浓度变化比=物质的量变化比
5.大小比较
(1)比较前提:同一反应,同一物质,同一单位
(2)换算方法:各物质的速率除以相应的化学计量数,数大的速率快
二、影响化学反应速率的因素
1.内因:反应物本身的性质
2.外因
(1)基本规律:条件越高,速率越快
①温度:温度越高,化学反应速率越快
②压强:气体反应的压强越大,化学反应速率越快
③浓度:浓度越大,化学反应速率越快
④催化剂:有催化剂,化学反应速率越快
⑤接触面积:反应物的颗粒越小,接触面积越大,化学反应速率越快
⑥原电池:形成原电池,可以加快氧化还原反应的速率
(2)特殊情况
①固体和纯液体的浓度为定值,量变化对速率无影响
②压强变化对非气体反应速率无影响
③催化剂:显著的改变(加快或减慢)正逆反应速率
④恒容容器通无关气体,压强增大,浓度不变,速率不变
⑤恒压容器通无关气体,体积变大,浓度减小,速率减慢
⑥催化反应:若升高温度,反应速率减慢,其可能的原因是催化剂失活
3.全程速率-时间图像
(1)OB段反应速率变化的可能原因为:
①反应放热,使温度升高,反应速率加快
②反应生成催化剂,反应速率加快
(2)BC段反应速率变化的可能原因为:反应物浓度降低,反应速率减慢
4.探究外界条件对化学反应速率的影响
(1)方法:控制变量法
(2)溶液反应:加水调节溶液的总体积不变,以保证某种成分的浓度不变
(3)实例:探究Y溶液浓度对反应速率的影响
实验(混合溶液)
1
2
3
4
5
6
4mol/LX溶液/mL
60
60
60
60
60
60
饱和Y溶液/mL
0
1.0
5.0
10
20
40
H2O/mL
40
39
35
30
20
0
考点5 化学反应的限度
一、可逆反应
1.可逆反应的判断:反应形式相反,反应条件相同
2.可逆反应的特点
(1)同步性:正逆反应同时进行
(2)等同性:反应条件完全相同
(3)共存性
①反应不可能进行到底,即反应体系中反应物与生成物共存
②各组分的浓度都大于零
3.证明某反应为可逆反应
(1)检验出某种生成物
(2)检验量少的反应物是否有剩余
二、化学平衡
1.化学平衡状态的特征
2.判断化学平衡状态的依据
(1)本质标志:v正=v逆
①同一组分的生成速率和消耗速率相等
②不同物质的正逆反应速率比等于化学计量数之比
(2)宏观标志:某些量开始变化,后来不变
①某组分的质量、物质的量、浓度、颜色不再变化
②反应物的转化率不再变化
(3)限度标志:可逆反应所能达到的最大程度
①反应物的转化率最大,百分含量最小
②生成物的产率最大,百分含量最大
(4)特殊情形
①绝热容器:容器的温度不变时,一定达到平衡状态
②可逆电池:电流或电压等于零时,一定达到平衡状态
3.判断化学平衡状态的常用公式
(1)混合气体的密度:ρ==
(2)混合气体的平均摩尔质量:==
(3)气体状态方程:PV=nRT
4.几种特殊反应的平衡依据
(1)量比不变型
①反应物或生成物量的比不变,不一定达到平衡状态
②反应物和生成物量的比不变,一定达到平衡状态
(2)量相等型
①反应物和生成物的量相等,不一定达平衡状态
②反应物和反应物的量相等,不一定达平衡状态
③量不变≠量相等≠量或量的比等于某一具体的数
(3)等体反应型:3A(g)2B(g)+C(g)
①恒温恒压:混合气体的体积不变,一定达到平衡状态
②恒温恒容:混合气体的压强不变,不一定达到平衡状态
(4)固液参与型:2A(g)2B(g)+C(s)
①混合气体的密度不变,一定达到平衡状态(恒T、V)
②混合气体的平均摩尔质量不变,一定达到平衡状态
(5)固液分解型:2A(s)2B(g)+C(g)
①混合气体的密度不变,一定达到平衡状态(恒T、V)
②混合气体的平均摩尔质量不变,不一定达到平衡状态
③某种气体组分的物质的量分数不变,不一定达到平衡状态
三、化学平衡的有关计算
1.计算模式——“三段式”
(1)确定反应物或生成物的起始加入量。
(2)确定反应过程的变化量。
(3)确定平衡量。
(4)依据题干中的条件,建立等量关系进行计算。
反应
aA(g)
+
bB(g)
cC(g)
+
dD(g)
起始量
m
n
0
0
转化量
ax
bx
cx
dx
平衡量
m-ax
n-bx
cx
dx
2.常用计算公式
(1)反应物的转化率:=×100%
(2)某组分的百分含量:含量=×100%
①常见量:体积分数、物质的量分数
②关系式:体积分数=物质的量分数
(3)气体状态方程:PV=nRT
条件
公式
文字叙述
同温同压
==
气体体积比=物质的量比=分子数比
同温同容
==
气体压强比=物质的量比=分子数比
同温同压同质量
===
气体密度比=气体体积反比
=物质的量反比=分子数反比
鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第1节 化学键与物质构成同步练习题: 这是一份鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第1节 化学键与物质构成同步练习题,共11页。试卷主要包含了36等内容,欢迎下载使用。
第3章 简单的有机化合物——【期末复习】高一化学单元复习知识点梳理(鲁科版2019必修第二册): 这是一份第3章 简单的有机化合物——【期末复习】高一化学单元复习知识点梳理(鲁科版2019必修第二册),共19页。
第1章 原子结构 元素周期律——【期末复习】高一化学单元复习知识点梳理(鲁科版2019必修第二册): 这是一份第1章 原子结构 元素周期律——【期末复习】高一化学单元复习知识点梳理(鲁科版2019必修第二册),共12页。