


- 必刷题13 难溶电解质的沉淀溶解平衡——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 3 次下载
- 必刷题14 工艺流程综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 7 次下载
- 必刷题16 化学反应原理综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 3 次下载
- 必刷题17 物质结构与性质的综合——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 2 次下载
- 必刷题18 有机化学基础的综合——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版) 试卷 5 次下载
必刷题15 化学实验综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版)
展开2023高考化学考前名校必杀题(全国卷)
非选择题基础必杀
必杀15 化学实验综合题(20题)
1.(2023·新疆·统考一模)“消洗灵”(Na10P3O13Cl·5H2O)是一种高效低毒的消毒洗涤剂。某兴趣小组实验室中利用反应:NaClO+Na3PO4 +2Na2HPO4+2NaOH+3H2O= Na10P3O13Cl·5H2O制备“消洗灵”,反应装置如图所示(夹持装置略)。
问答下列问题:
(1)仪器a的名称是___________,装置A中反应的离子方程式为___________。
(2)装置C的作用是___________。装置B中采用多孔球泡的目的是___________。
(3)打开仪器a的活塞及活塞K,制备NaClO碱性溶液;关闭仪器a的活褰及活塞K,打开裝置B中分液漏斗活塞; 一段时间后,装置B中溶液经“系列操作”,得到粗产品。
①上述装置存在一处缺陷,会使”消洗灵”(Na10P3O13Cl·5H2O)的产率降低,改进的方法是___________。
②“系列操作”包括___________、___________、过滤、洗涤、低温干燥。
(4)利用滴定法测定产品的纯度(Na10P3O13Cl·5H2O)的摩尔质量为656. 5g ·mol-1,实验方案如下:
I.取4.00g产品试样溶于蒸馏水中配成200mL溶液;
II.量取20. 00 mL待测液于锥形瓶中,加入10 mL2 mol·L-1硫酸溶液、25 mL0.1 mol·L-1KI溶液(过量) ,暗处静置5min;
III.滴加2~3滴淀粉溶液,用0. 0500 mol ·L-1Na2S2O3标准溶液滴定,发生反应: I2+2 =2I-+ 。平行滴定三次,平均消耗20. 00 mL标准溶液。
①Na2S2O3标准液应放在___________ ( 填“碱”或“酸”)式滴定管中。
②则产品的纯度为___________(保留三位有效数字)。
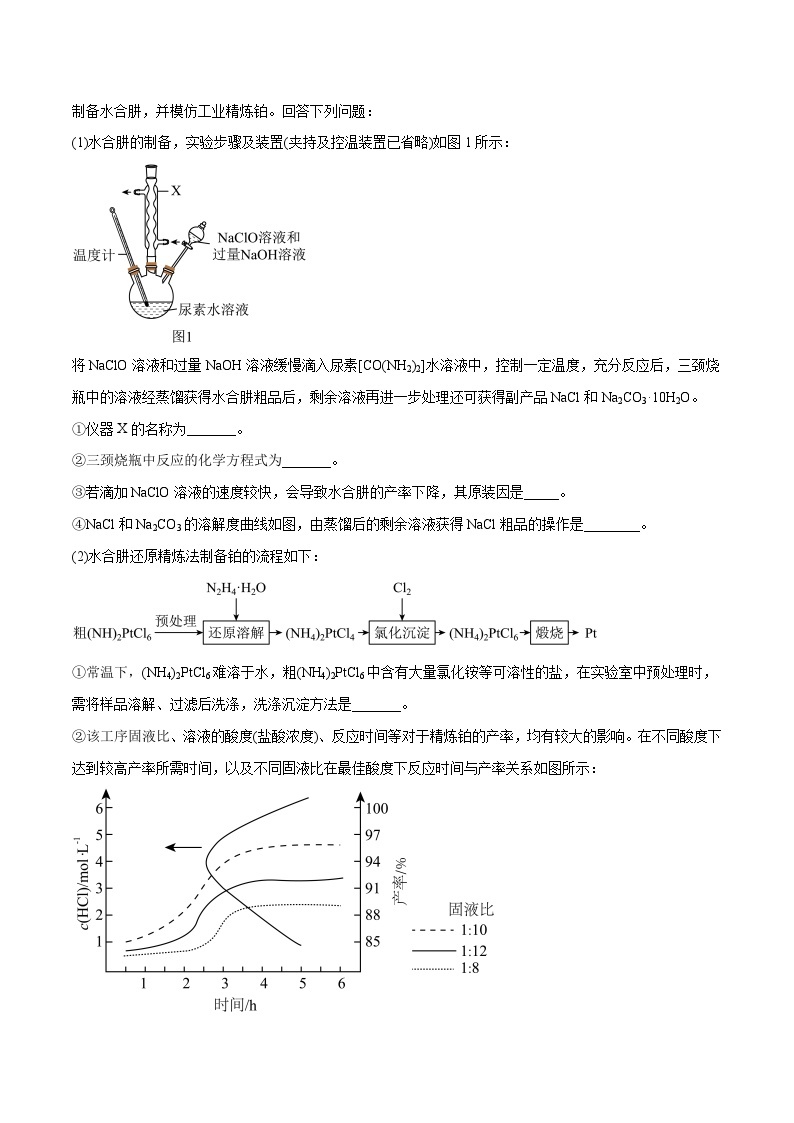
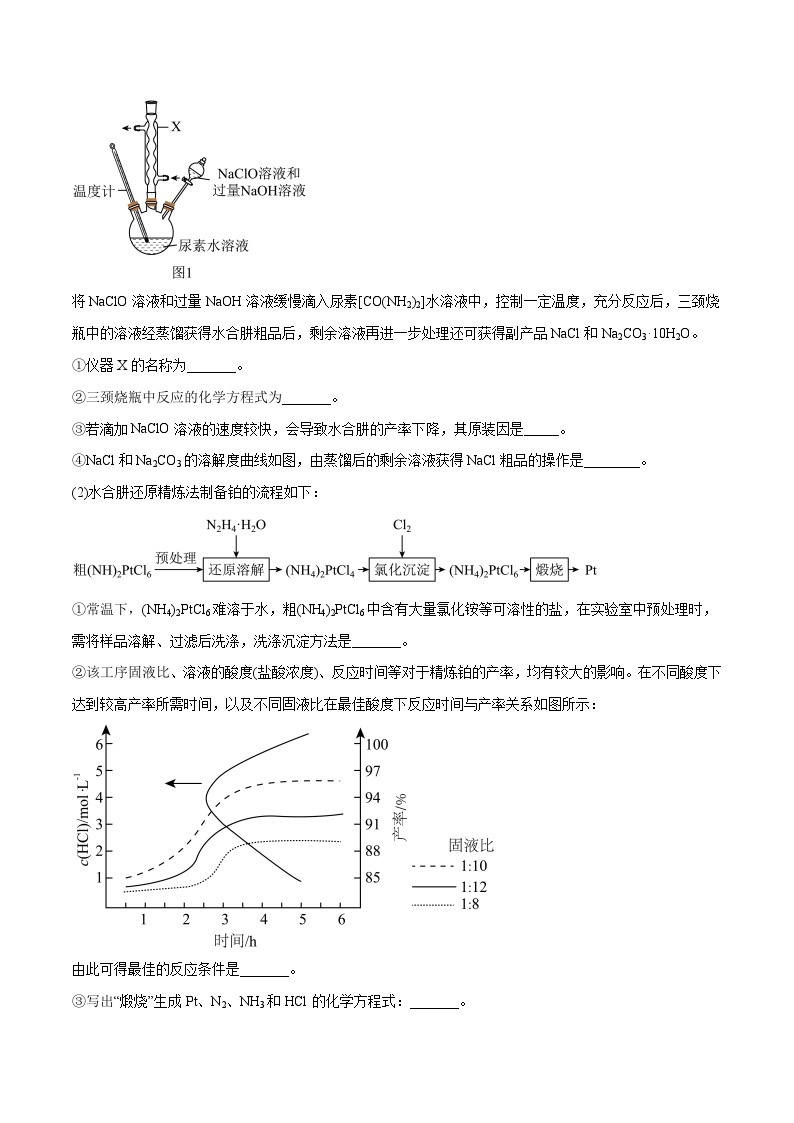
2.(2023·黑龙江齐齐哈尔·统考一模)水合肼(N2H4·H2O)具有还原性,利用其可以精炼铂。某同学在实验室制备水合肼,并模仿工业精炼铂。回答下列问题:
(1)水合肼的制备,实验步骤及装置(夹持及控温装置已省略)如图1所示:
将NaClO溶液和过量NaOH溶液缓慢滴入尿素[CO(NH2)2]水溶液中,控制一定温度,充分反应后,三颈烧瓶中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。
①仪器X的名称为_______。
②三颈烧瓶中反应的化学方程式为_______。
③若滴加NaClO溶液的速度较快,会导致水合肼的产率下降,其原装因是_____。
④NaCl和Na2CO3的溶解度曲线如图,由蒸馏后的剩余溶液获得NaCl粗品的操作是________。
(2)水合肼还原精炼法制备铂的流程如下:
①常温下,(NH4)2PtCl6难溶于水,粗(NH4)2PtCl6中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解、过滤后洗涤,洗涤沉淀方法是_______。
②该工序固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示:
由此可得最佳的反应条件是_______。
③写出“煅烧”生成Pt、N2、NH3和HCl的化学方程式:_______。
3.(2023·湖南郴州·统考三模)实验室采用三氟化硼与氯化铝加热的方法制备,装置如图所示(夹持及加热装置略)。
已知:
Ⅰ.三氟化硼易与水反应;三氯化硼易潮解;三氯化铝)沸点低、易升华。
Ⅱ.部分物质的沸点如表所示:
物质
沸点/℃
-101
12.5
180
Ⅲ.
回答下列问题:
(1)将氟硼酸钾和硼酐一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,则发生反应的化学方程式为_______。
(2)装置B中的试剂是_______(填化学名称),仪器a的作用是_______。
(3)装置D进行_______(填“冰水浴”或“热水浴”)可得到产品,如果缺少装置E,造成的影响为_______。
(4)C中2.50g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸,将所得溶液加水稀释到100mL,取10mL加入锥形瓶中滴入2滴酚酞溶液,用的NaOH溶液滴定至终点,消耗NaOH溶液的体积为12.00mL。
①到达滴定终点的现象为_______。
②计算的产率为_______%(保留一位小数)。
4.(2023·湖南衡阳·校联考二模)碘酸钾是常用的食盐加碘剂。某研究小组在实验室采用如下两种方法进行碘酸钾的制备。
方法一:采用如图所示装置,先用高锰酸钾制备氯气,再用氯气氧化碘化钾得到碘酸钾溶液,再经一系列步骤得到碘酸钾产品。
方法二:采用如下实验流程,直接用高锰酸钾氧化碘化钾得到碘酸钾溶液,再经一系列步骤得到碘酸钾产品。
已知:(Ⅰ)是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
(Ⅱ)溶液在中性条件下的还原产物为一种不溶于水的沉淀。
(1)方法一中装置a的作用是净化,其中的试剂为_______,装置b的名称为_______。
(2)方法一中多孔球泡装置的作用是_______。
(3)方法二中水浴加热时发生反应的化学方程式为_______。
(4)方法二中滴入适量乙醇的作用是_______。
(5)在获取碘酸钾产品的操作中,下列说法正确的是_______(填字母序号)。
A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器
B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净
C.采用抽滤可使过滤速率加快
D.为提高洗涤效果,可用热水进行洗涤
(6)方法二所得产品碘酸钾的纯度测定方案如下:准确称取产品配制成溶液作为待测液,取该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化,盖紧塞子,置于避光处,用的硫代硫酸钠标准溶液滴定,当溶液呈淡黄色时,加入少许指示剂,滴定到溶液为无色。平行滴定三次,平均消耗标准液,计算产品的纯度。已知:。
①指示剂宜选用_______溶液;
②产品碘酸钾的质量分数为_______。
5.(2023·甘肃·统考一模)硝基苯常作有机合成中间体及用作生产苯胺的原料。实验所需物质的物理性质如下表:
名称
相对分子质量
熔点/℃
沸点/℃
溶解性
苯
78
5.5
80.1
不溶于水,易溶于乙醇
硝基苯
123
5.7
210.9
不溶于水,易溶于乙醇、乙醚、苯
实验室制取硝基苯常规方法:在大试管中将浓硝酸和浓硫酸按体积比2:3混合,摇匀、冷却后滴入苯,水浴加热至55℃~ 60℃,即可制得硝基苯。某实验小组将该实验进行改进,以N2O5为绿色硝化剂制取硝基苯的反应原理、实验装置及实验步骤如下:
反应方程式:+N2O5 +HNO3
实验步骤:
I.将100 mL浓度为0.108g·mL-1N2O5的CH2Cl2溶液加入到装有高选择性分子筛催化剂(NaY)的反应器中。
II.在搅拌状态下,将一定量的苯用仪器X滴加至反应器中,使C6H6与N2O5物质的量之比达到1:1.2,并控制反应温度在15℃以下。
III.滴加完毕后继续搅拌一段时间,将反应器中的液体倒入饱和KHCO3溶液中,分液得到粗产品。
IV.将粗产品进一步纯化得到硝基苯 7.626 g。
回答下列问题:
(1)仪器X的名称___________,常规法制取硝基苯的化学方程式为___________,配制浓硫酸和浓硝酸的混合液的操作是___________。
(2)对比常规法,以N2O5制取硝基苯的方法更符合“绿色化学”理念,理由是___________。
(3)准确配制100 mL浓度为0.108 g· mL-1N2O5的CH2Cl2的溶液用到的玻璃仪器有烧杯、量筒、胶头滴管、___________。
(4)“步骤II”中用图示装置的夹套三口烧瓶控制反应温度在15℃以下,冰水应从___________口进入(选填“a”或“b”),“步骤III”中饱和KHCO3的作用是___________ ,“步骤IV”中“进一步纯化” 的方法是___________。
(5)若忽略提纯过程中硝基苯的损耗,N2O5的转化率为___________%。
6.(2023·贵州贵阳·统考一模)铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
I.铁元素的检验
(1)“操作”是指___________;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的___________(填写仪器名称)。
(2)取待测液少许,滴加K3[Fe(CN)6]溶液,观察到有蓝色沉淀生成;另取待测液少许,滴加___________(填化学式)溶液,观察到溶液变为红色,由此可得出结论___________(填字母序号)。
a.黑木耳中一定含Fe2+和Fe3+
b.待测液中一定含Fe2+和Fe3+
II.铁元素含量的测定
(3)利用KMnO4标准溶液测定干黑木耳样品中铁元素的含量
步骤I:取10.00mL待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤II:向步骤I所得的溶液中加入适量稀H2SO4溶液,用0.0020mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液2.20mL。
①步骤I加入过量铜粉的目的是___________。
②步骤II滴加KMnO4溶液时发生反应的离子方程式为___________。
③用KMnO4标准溶液滴定至终点的标志是。___________。
④黑木耳中铁的含量为___________mg/100g(即每100g黑木耳中含铁元素的质量)。
7.(2023·四川巴中·统考一模)硫代硫酸钠(Na2S2O3)在工业、医药等领域应用广泛。下图为实验室制取硫代硫酸钠的装置,反应过程中需通过pH传感器控制pH为7-8。
(1)盛Na2SO3的仪器名称为___________。
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是___________。
(3)若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:___________。
(4)当数据采集处pH接近7时,应采取的操作为___________。
(5)装置B中的药品可以选择下列物质中的___________(填字母)。
A.饱和NaHCO3溶液 B.饱和NaHSO3溶液
C.NaOH溶液 D.酸性KMnO4溶液
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为:___________。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量___________(填“偏大”、“偏小”、“无影响”)。
③脱碳液中V2O5的质量分数为___________%。
8.(2023·辽宁抚顺·统考模拟预测)溴酸钠应用广泛,“氯气氧化法”制备装置如下:
(1)装置I中发生反应的还原剂与还原产物物质的量之比为___________。
(2)装置II的作用是___________。
(3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,先打开电热磁力搅拌器,升温至50-60℃,滴入适量液溴。然后打开活塞___________,当pH传感器显示接近中性时,关闭所有活塞。反应结束后,在拆卸装置前为避免I中残留较多的污染空气,应打开活塞___________。
(4)装置III中发生总反应的离子方程式为___________。
(5)实验完毕后,使用图甲(作用为趁热过滤)、图乙装置对装置Ⅲ中混合物进行分离。得到产品。已知:有关物质在不同温度下的溶解度曲线如下图:
下列有关说法正确的是___________(填序号)。
a.选择图甲装置的优点是避免过滤过程中析出晶体
b.分离过程为:趁热过滤,蒸发结晶,抽滤,洗涤,干燥
c.选择图乙装置的优点是抽滤速率快,使产品更加干燥
(6)取ag产品,加蒸馏水至250mL溶液,取25.00 mL于碘量瓶中,加入过量KI溶液和适量稀硫酸,暗处密封静置5min。加入淀粉指示剂,用标准溶液滴定,滴定至终点,平行滴定三次,消耗体积分别为20.02mL、19.00mL、19.98mL;另取25.00mL蒸馏水作空白试验,平均消耗标准溶液VmL。(假设杂质不与KI反应,涉及的反应为,)。
判断达到滴定终点的现象为___________。产品质量分数为___________(用含a,c,V的代数式表示)。
9.(2023·山西忻州·统考一模)炭粉、CO、H2均可作为实验室还原CuO的还原剂,实验小组对CuO的还原反应及还原产物组成进行探究。
查阅资料: PdCl2溶液能吸收CO,生成黑色Pd沉淀、一种氢化物和一种氧化物。
回答下列问题:
(1)铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为___________。
A.577~492 nm B.597~577 nm C. 622~597 nm
(2)基态Cu+的价电子轨道表示式为___________。
(3)小组同学用如图所示装置探究炭粉与CuO反应的产物。
①实验结束后,打开开关K通氮气,其目的是___________。
②试剂X的作用为___________。
③若气体产物中含有CO,则观察到的现象为______, 其中反应的化学方程式为_______。
(4)某小组同学为测定炭粉还原CuO后固体混合物(仅有C和Cu2O)两种杂质)中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸(恰好使固体溶解达到最大值),过滤、洗涤、干燥,所得沉淀的质量为0.160g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25. 00 mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.5000 mol· L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12. 00 mL。已知:2Cu2++5I-=2CuI↓ + ,+2= +3I-。
①还原后固体混合物中单质Cu的质量分数为___________%。
②若CuI吸附部分 ,会导致所测Cu单质的质量分数___________ (填“偏大”、“偏小”或“无影响”)。
10.(2023·河南·统考三模)三氯化氧磷(POCl₃)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。研究小组在实验室模拟反应CPCl3+SO2+Cl2POCl3+SOCl2,制备POCl3并测定产品的含量。
资料卡片:
物质
熔点/℃
沸点/℃
有关性质
PCl₃
-93.6
76.1
遇水剧烈水解,易与O₂反应
POCl₃
1.25
105.8
遇水剧烈水解,能溶于PCl₃
SOCl₂
-105
78.8
遇水剧烈水解,受热易分解
(1)甲装置中盛放的试剂为___________,洗气瓶甲、丁的作用是净化原料气体和___________,实验室制备SO₂的化学方程式为___________。
(2)反应装置图中装置丙、戊间方框内未画出的仪器应选择___________(填“球形冷凝管”或“直形冷凝管”),如果没有装置戊,可能发生的反应是___________(写一个即可)。
(3)该实验需控制反应温度60-65℃,则温度不宜过高和过低的原因是___________,该实验应采用的加热方式为___________。
(4)测定提纯后产品中POCl₃的含量:准确称取1.700g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mol·L⁻¹的AgNO₃溶液20.00mL(发生的反应为Ag⁺+Cl⁻=AgCl↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入指示剂,用0.1000mol·L⁻¹KSCN标准溶液滴定过量的AgNO₃至终点(Ag⁺+SCN⁻=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①滴定选用的指示剂是___________(填标号)。
a.酚酞 b.淀粉 c.NH₄Fe(SO4)2 d.甲基橙
②产品中POCl₃的质量分数为___________%(保留三位有效数字)。
③已知:Ksp(AgCl)=3.2×10⁻10,Ksp(AgSCN)=2×10⁻¹²,若无硝基苯覆盖沉淀表面,测定产品中POCl₃的质量分数将___________(填“偏大”“偏小”或“无影响”)。
11.(2023·广东湛江·统考一模)某实验小组为探究含硫化合物的性质,设计如下实验探究的氧化性。
实验操作:向小试管中加入溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在。
(1)与反应的离子方程式为___________。
(2)检验该溶液中存在的具体操作及现象为___________。
(3)实验结论:的氧化性___________(填“强于”或“弱于”)。
已知:可与发生反应:。为了进一步探究与的反应速率,小组同学设计下表实验:
试验编号
溶液/
溶液/
蒸馏水/
0.4%的淀粉溶液/滴
溶液/
变色时间/
Ⅰ
4.0
0
4.0
2
2.0
立即
Ⅱ
4.0
1.0
3.0
2
2.0
30
(4)上述两实验中均加入了不同体积的蒸馏水,其目的为___________。
加入溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:先与反应,消耗完后才与反应;
猜想2:与反应的速率远低于与反应的速率。
为验证上述猜想,小组同学补充下表实验:
试验编号
KI溶液/
碘水/
溶液/
0.4%的淀粉溶液/滴
溶液/
实验现象
Ⅲ
2
0
20
10
0
0.2
下层溶液显浅紫色
Ⅳ
0
5
20
0
2
20
溶液先变蓝,后迅速褪色,一段时间后又变蓝
(5)验证猜想1的实验设计为___________(填“实验Ⅱ”或“实验Ⅳ”下同),验证猜想2的实验设计为___________。
(6)下层溶液显浅紫色的原因为___________。
(7)由上述实验可知___________(填“猜想1”或“猜想2”)成立。
12.(2023·四川凉山·统考二模)硫酸铜主要用作纺织品媒染剂、农业杀虫剂等,其晶体(CuSO4·xH2O)在不同温度下会逐步失去结晶水甚至分解。某小组对硫酸铜晶体性质进行探究,回答下列问题:
[探究一]验证硫酸铜晶体的分解产物
某小组同学对某温度下硫酸铜晶体的分解产物进行验证,设计了如下实验:
观察到的实验现象有:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中无水硫酸铜变蓝;C中产生白色沉淀;D中品红溶液褪色;E中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为_______,C、D两装置位置_______ (填“ 能”或“不能”)交换。
(2)C中产生的沉淀的化学式为_______,E中Fe2+发生反应的离子方程式为______。
(3)该实验设计的不足之处是_______。
[探究二]测定硫酸铜晶体中结晶水含量
实验步骤:①称取mg硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴酸A酸化。
②向①所得溶液中滴加足量BaCl2溶液,得到白色沉淀,将所得沉淀过滤、洗涤。
③将洗涤后的沉淀充分干燥后称得其质量为ag。
(4)步骤①酸A应该选择_______ ( 填“稀盐酸”或者“稀硫酸”),滴加酸A的目的是______。
(5)步骤②检验沉淀是否洗涤干净的方法是_______。
(6)根据实验数据,硫酸铜晶体( CuSO4·xH2O)中x=_______ (用含 m、a的代数式表示)。
13.(2023·山东枣庄·统考二模)三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室可利用下面装置模拟制取三氯化铬(、为气流控制开关)。
原理:
已知:气体有毒,遇水发生水解产生两种酸性气体
(1)实验装置合理的连接顺序为a—___________(填仪器接口字母标号)。
(2)步骤如下:
i.连接装置,检查装置气密性,装入药品并通;
ii.加热反应管至400℃;
iii.控制开关,加热,温度保持在50℃~60℃之间;
iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关、的状态分别为___________。
②补全步骤v的操作:___________,其目的是___________。
(3)从安全的角度考虑,整套装置的不足是___________。
(4)装置D中反应的离子方程式为___________。
(5)取三氯化铬样品0.300g,配制成250mL溶液。移取25.00mL于碘量瓶中,加热至沸腾后,加适量溶液,生成绿色沉淀。冷却后,加足量30% ,小火加热至绿色沉淀完全溶解。冷却后,加入酸化,再加入足量KI溶液,加塞摇匀充分反应后,铬元素只以存在,暗处静置5min后,加入指示剂,用标准溶液滴定至终点,消耗标准溶液21.00mL(杂质不参加反应)。
已知:;
①绿色沉淀完全溶解后,继续加热一段时间再进行后续操作,目的是___________。
②样品中无水三氯化铬的质量分数为___________(结果保留三位有效数字)。
③若将碘量瓶换为锥形瓶,则样品中无水三氯化铬质量分数的测量结果___________(填“偏高”、“偏低”或“无影响”)。
14.(2023·江西赣州·统考一模)FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等,实验室可用无水四氯化锡(SnCl4)制作FTO,制备SnCl4的装置如图所示。
有关信息如下表:
化学式
Sn
SnCl2
SnCl4
熔点/°C
232
246
-33
沸点/°C
2260
652
114
其他性质
银白色固体金属
无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+
无色液体,易水解生成SnO2
(1)仪器A的名称为___________,甲中发生反应的还原产物和氧化产物的物质的量之比为___________。
(2)将如图装置连接好,先检查装置的气密性,再慢慢滴入浓盐酸,待观察到___________现象后,开始加热装置丁。
(3)Cl2和Sn的反应产物可能会有SnCl4和SnCl2,为加快反应速率并防止产品中带入SnCl2,除了通入过量氯气外,应控制的最佳温度在___________(填序号)范围内。A.652~2260°C B.232~652°C C.114~246°C D.114~232°C
(4)若将制得的SnCl4少许溶于水中得到白色沉淀SnO2,其反应的化学方程式为___________。
(5)为测定产品中某些成分的含量,甲、乙两位同学设计了如下实验方案:
①实际制备的产品往往含有SnCl2,甲同学设计实验测定Sn2+的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,用amol/L酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液V1mL。由此可计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是___________。
②乙同学设计实验测定产品中Cl-的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V2mL。硝酸银溶液最好盛放在___________(填序号)滴定管中。
A.无色酸式滴定管B.棕色酸式滴定管C.无色碱式滴定管D.棕色碱式滴定管
参考表中的数据,X溶液最好选用的是___________(填序号)。
难溶物
AgCl
AgBr
AgCN
Ag2CrO4
颜色
白
浅黄
白
砖红
Ksp
1.77×10-10
5.4×10-14
2.7×10-16
1.12×10-12
A.NaCl溶液B.NaBr溶液C.NaCN溶液D.Na2CrO4溶液
15.(2023·河南·校联考一模)某学习小组在实验室中利用下图装置(部分装置略去)测定某铁硫化物(FexSy)的组成,并探究反应结束后装置D所得溶液中含硫化合物的组成。
实验步骤:
步骤一:如图依次连接装置,检查装置气密性,装入试剂;
步骤二:打开分液漏斗活塞与旋塞,并点燃酒精喷灯:
步骤三:足够长时间后,装置D中产生气泡速率变快时,停止加热,继续向装置A中的烧瓶滴水一段时间;
步骤四:实验结束后,将装置D中所得溶液加水配制成100mL溶液。
请回答下列问题:
(1)盛水仪器的名称为___________,C中使用酒精喷灯而不使用酒精灯的原因是___________。
(2)检查装置A气密性的方法是___________。
(3)装置A中反应的离子方程式为___________。
(4)装置D的作用是___________,检验反应后 D装置溶液中含硫阴离子的方法是___________。
(5)取25. 00 mL步骤四中所配溶液,加入足量的H2O2,再加入足量经稀盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为23.3g,则FexSy与O2反应的化学方程式为___________。
16.(2023·湖南·校联考二模)磷酸亚铁锂(化学式:LiFePO4),为近年来新开发的锂离子电池电极材料,主要用于动力锂离子电池,作为电极活性物质使用,能可逆地嵌入、脱出锂,其作为锂离子电池电极材料的研究及应用得到广泛关注。通过水热法制备磷酸亚铁锂的一种方法如图(装置如图所示,夹持装置、加热装置等省略未画出):
制备步骤:
I.在仪器A中加入40mL蒸馏水、0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌。
II.向反应液中加入少量抗坏血酸(维生素C),继续搅拌5min。
III.快速将反应液装入反应釜中,保持170℃恒温5h。
IV.冷却至室温,过滤。
V.用蒸馏水洗涤沉淀。
VI.干燥,得到磷酸亚铁锂产品。
回答下列问题:
(1)装置图中仪器A的名称是_____,根据上述实验药品的用量,A的最适宜规格为_____(填标号)。
A.50mL B.100mL C.250mL D.500mL
(2)步骤II中,抗坏血酸的作用是______,以下能代替抗坏血酸使用的是_____(填标号)。
A.Na2SO3 B.铁粉 C.酸性高锰酸钾溶液
(3)若所加H3PO4、FeSO4•7H2O、LiOH•H2O恰好完全反应,请写出制备磷酸亚铁锂的化学方程式:______。
(4)确定所得产品中未混有Fe(OH)3、FePO4杂质的方法是_____。
(5)干燥后称量,若实验共得到无杂质产品1.1g,则LiFePO4的产率为_____%(保留小数点后一位)。
(6)某种以LiFePO4作电极材料的锂电池总反应可表示为LiFePO4+CLi1-xFePO4+CLix。放电时正极的电极反应式为_____。
17.(2023·重庆万州·重庆市万州第二高级中学校考模拟预测)甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。
取一定量的溶液、溶液和甲醛于锥形瓬中,控制温度为40~50℃回流,收集到大量气体,并有红色沉淀生成。
(1)①“控制温度为40~50℃”的常用加热方法是___________。
②气体能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是___________。
(2)在探究甲醛的氧化产物时,发现未生成。为了进一步确定甲醛是否被氧化为,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成,而可将银氨溶液还原成银单质)。
①仪器a的名称是___________。
②b中,溶液的作用是___________。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为___________。
(3)已知:(无色),遇空气容易被氧化成(蓝色);验证红色沉淀中含,进行如下实验步骤和现象记录:取样品,___________,说明红色固体中含。
(4)若最终测得红色沉淀为和少量的,且的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成和气体X的化学方程式___________。
18.(2023·辽宁·朝阳市第一高级中学校联考一模)钛在医疗领域的应用非常广泛,如:制人造关节、主动心瓣等。是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备(夹持装置略)。
资料表明:室温下,为无色液体,易挥发,高温时能与反应,与HCl不发生反应。其他相关信息如下表所示:
物质
熔点/℃
沸点/℃
水溶性
-25
136.4
易水解成白色沉淀,能溶于有机溶剂
-23
76.8
难溶于水
请回答下列问题:
(1)A中反应的离子方程式为_______。
(2)盛放的仪器名称为_______,装置B中盛放的试剂是_______(写名称)。
(3)加热装置C之前,先进行装置A中的反应,这样操作的目的是_______。
(4)装置C中除生成外,同时还生成一种有毒气体,该反应的化学方程式为_______。
(5)该实验设计存在缺陷:一是无CO尾气处理装置;第二个缺陷的改进措施为_______。
(6)利用如图装置测定所得的纯度:将产品加入烧瓶,向安全漏斗中加入适量蒸馏水发生反应,待充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴指示剂,用溶液滴定至终点,消耗滴定液25.00mL。
①在滴定管中装入标准溶液的前一步应进行的操作为_______。
②已知常温下,,,,(呈砖红色,溴化银呈浅黄色),应选择的指示剂是_______。
A.KCl B. C.KBr
③根据上述数据计算该产品的纯度为_______%。
19.(2023·山西·统考一模)硫氰化钾( KSCN)是一种重要的无机物,主要用于合成树脂、杀虫杀菌剂等,也是Fe3+的常用指示剂。实验室模拟工业制备硫氰化钾( KSCN)实验装置如图:
已知:CS2不溶于水,密度比水大;NH3不溶于CS2。
实验步骤如下:
I.检查装置的气密性。
(1)关闭K1、K3,打开K2,依据滴液漏斗中的水能否顺利流下检查装置B的气密性是否合理 _______。(填“合理”或“不合理”)
II.制备NH4SCN溶液:CS2+ 3NH3 NH4SCN + NH4HS。
检查装置的气密性良好,向三颈烧瓶内加入CS2、水和催化剂,CS2液体必须浸没导气管口,实验开始时打开K1,关闭K2、K3,加热装置A、B.回答下列问题:
(2)装置A中的大试管可以盛放的试剂为 _______。( 填序号)
A.浓氨水 B.NH4Cl和Ca(OH)2 C.NH4HCO3 D.NH4Cl
(3)CS2不仅作为反应物充分参加反应,其作用还有 _______、 _______。
III.制备KSCN晶体:
移去A处的酒精灯,关闭K1,将B与C或D连接,打开K3,移开水浴装置,将装置B继续加热至105 °C,使NH4HS完全分解(产生两种气体),然后再打开K2,缓慢滴入K2CO3溶液,持续加热充分反应生成产品的同时产生两种气体,反应结束后先滤去三颈烧瓶中的固体催化剂,再蒸发浓缩、冷却结晶、过滤、干燥,得到硫氰化钾晶体粗产品。
(4)B应和_______(填C或 D)连接。
(5)写出滴入K2CO3溶液时,装置B中发生反应的化学方程式是 _______。
(6)酸性K2Cr2O7溶液可吸收NH4HS分解产生的两种气体,溶液中出现淡黄色的浑浊,写出生成淡黄色浑浊的离子方程式 _______。
(7)硫氰化钾晶体粗产品精制的方法是 _______。
20.(2023·广东广州·统考一模)醋酸钠是一种常用的防腐剂和缓冲剂。
(1)配制溶液,需要称量醋酸钠晶体(,)的质量为_______。实验需要的仪器有天平、药匙、玻璃棒、量筒、_______(从下列图中选择,写出名称)。
(2)某小组探究外界因素对水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为):
i.实验_______和_______(填序号),探究加水稀释对水解程度的影响;
ii.实验1和3,探究加入对水解程度的影响;
iii.实验1和4,探究温度对水解程度的影响。
序号
温度
1
25℃
40.0
0
0
2
25℃
4.0
0
36.0
3
25℃
20.0
10.0
4
40℃
40.0
0
0
①根据甲同学的实验方案,补充数据:_______。
②实验测得,该结果不足以证明加入促进了的水解。根据_______(填一种微粒的化学式)的浓度增大可以说明加入能促进的水解。
③已知水解为吸热反应,甲同学预测,但实验结果为。实验结果与预测不一致的原因是_______。
(3)小组通过测定不同温度下的水解常数确定温度对水解程度的影响。
查阅资料:,为溶液起始浓度。
试剂:溶液、盐酸、计。
实验:测定40℃下水解常数,完成下表中序号7的实验。
序号
实验
记录的数据
5
取溶液,用盐酸滴定至终点
消耗盐酸体积为
6
测40℃纯水的
7
_______
在50℃和60℃下重复上述实验。
数据处理:40℃,_______(用含、、的计算式表示)
实验结论:,温度升高,促进水解。
必刷题18 有机化学基础的综合——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版): 这是一份必刷题18 有机化学基础的综合——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题18有机化学基础的综合高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题18有机化学基础的综合高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共67页, 欢迎下载使用。
必刷题16 化学反应原理综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版): 这是一份必刷题16 化学反应原理综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题16化学反应原理综合题高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题16化学反应原理综合题高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共79页, 欢迎下载使用。
必刷题14 工艺流程综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版): 这是一份必刷题14 工艺流程综合题——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷题(全国卷)(原卷版+解析版),文件包含必刷题14工艺流程综合题高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷解析版docx、必刷题14工艺流程综合题高考三轮冲刺2023年高考化学考前20天冲刺必刷题全国卷原卷版docx等2份试卷配套教学资源,其中试卷共61页, 欢迎下载使用。