

(寒假班)人教版高中化学必修第二册同步讲义第六章化学反应与能量第一节 化学反应与能量变化(含详解)
展开【学习目标】
1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.能用化学键解释某些吸热反应和放热反应。
3.设计实验认识构成原电池的条件。
4.理解原电池的概念及工作原理,能正确判断原电池的正负极。
5.知道干电池、充电电池、燃料电池等化学电源的特点。
6.掌握构成电池的要素,了解不同电极材料对电池性能的影响。
7.能正确书写简单化学电源的电极反应式。
【基础知识】
一、化学反应与热能
1、实验探究
(1)向Mg与稀盐酸反应的溶液中插入温度计,温度计显示的温度 升高 ,说明该反应为 放热 反应。
(2)将20 g Ba(OH)2·8 H2O晶体粉末与10 g NH4Cl晶体混合放入烧杯中,将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到有 刺激性 气味时用玻璃片盖上烧杯,用手触摸杯壁下部感觉 冰凉 ,烧杯与木片间有 结冰 现象,说明该反应为 吸热 反应。
2、放热反应与吸热反应
(1)放热反应: 释放热量 的化学反应,如活泼金属与酸的反应,燃烧反应,中和反应等。
(2)吸热反应: 吸收热量 的化学反应,如氢氧化钡与氯化铵的反应,盐酸与碳酸氢钠的反应,灼热的炭与二氧化碳的反应。
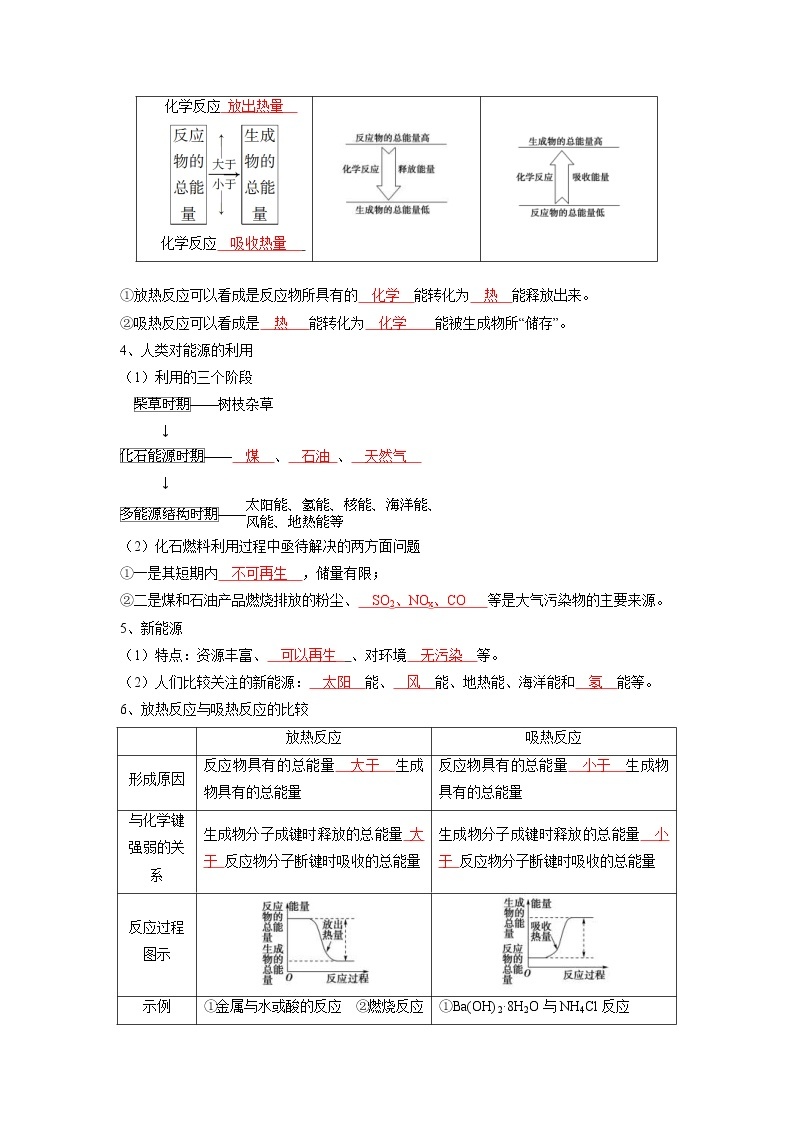
3、化学反应存在能量变化的原因
(1)从化学键的变化理解——主要原因
(2)从物质储存化学能的角度理解
= 1 \* GB3 \* MERGEFORMAT ①放热反应可以看成是反应物所具有的 化学 能转化为 热 能释放出来。
= 2 \* GB3 \* MERGEFORMAT ②吸热反应可以看成是 热 能转化为 化学 能被生成物所“储存”。
4、人类对能源的利用
(1)利用的三个阶段
eq \x(柴草时期)——树枝杂草
↓
eq \x(化石能源时期)—— 煤 、 石油 、 天然气
↓
eq \x(多能源结构时期)——eq \a\vs4\al(太阳能、氢能、核能、海洋能、,风能、地热能等)
(2)化石燃料利用过程中亟待解决的两方面问题
= 1 \* GB3 \* MERGEFORMAT ①一是其短期内 不可再生 ,储量有限;
= 2 \* GB3 \* MERGEFORMAT ②二是煤和石油产品燃烧排放的粉尘、 SO2、NOx、CO 等是大气污染物的主要来源。
5、新能源
(1)特点:资源丰富、 可以再生 、对环境 无污染 等。
(2)人们比较关注的新能源: 太阳 能、 风 能、地热能、海洋能和 氢 能等。
6、放热反应与吸热反应的比较
二、化学能转化为电能
1、火力发电
(1)火力发电原理:通过 化石燃料 燃烧时发生的氧化还原反应,使 化学 能转化为 热能 ,加热水使之汽化为蒸汽以推动蒸汽轮机,带动 发电机 发电。间接实现了 化学能 转化为电能。
(2)能量转换过程: 化学 能eq \(―――→,\s\up9(燃料燃烧)) 热 能eq \(―――→,\s\up9(蒸汽轮机)) 机械 能eq \(――→,\s\up9(发电机)) 电 能。其中能量转换的关键环节是 燃烧(氧化还原反应) 。
2、化学能直接转化为电能——原电池
(1)定义:把 化学 能转化为 电 能的装置叫原电池。
(2)原理:负极:发生 氧化 反应,电子 流出 。
正极:发生 还原 反应,电子 流入 。
3、原电池的生活示例——水果电池
(1)水果电池中,水果的作用是 提供电解质溶液 。
(2)水果电池中,选择电极材料时应注意两电极不能相同,其中有一电极为活泼金属如Al、Fe等,另一电极可以是Cu片或 石墨棒 等。
4、常见的化学电源
(1)锌锰干电池
= 1 \* GB3 \* MERGEFORMAT ①结构:锌锰干电池是以锌筒作 负 极,石墨棒作 正 极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质溶液 。
= 2 \* GB3 \* MERGEFORMAT ②原理:锌锰干电池属于 一次性 电池,放电之后 不能 充电(内部的氧化还原反应无法逆向进行)。负极发生的电极反应为 Zn-2e-===Zn2+ ,正极发生的电极反应为2MnO2+2NHeq \\al(\s\up1(+),\s\d1(4))+2e-===Mn2O3+2NH3↑+H2O。
(2)充电电池
= 1 \* GB3 \* MERGEFORMAT ①充电电池属于 二次 电池。有些充电电池在放电时所进行的 氧化还原 反应,在充电时可以 逆向 进行,生成物重新转化为反应物,使充电、放电可在一定时间内循环进行。
= 2 \* GB3 \* MERGEFORMAT ②常见充电电池:铅酸蓄电池、 镍氢电池 、锂离子电池等。
【考点剖析】
考点一 化学能与热能的相互转化
1.下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需加热就能发生
C.需要加热才能发生的反应不一定是吸热反应
D.化学反应是放热还是吸热取决于反应物和生成物所具有的总能量的相对高低
答案 B
解析 化学反应在发生物质变化的同时还一定伴随着能量的变化,故A正确;放热反应有的需加热,有的不需加热,如铝热反应是放热反应,但需要加热,故B错误,C正确;反应放热或吸热由反应物和生成物总能量的相对高低决定,故D正确。
2.下列变化过程,属于放热反应的是( )
①液态水变成水蒸气
②Ba(OH)2·8H2O与NH4Cl的反应
③Al与Fe3O4高温下反应
④固体NaOH溶于水
⑤H2在Cl2中燃烧
⑥食物腐败
A.②⑤⑥ B.②③④
C.③④⑤ D.③⑤⑥
答案 D
解析 ①、④不是化学反应,②是吸热反应。
考点二 化学反应中能量变化的原因
3.已知反应A+B===C+D的能量变化如图所示,下列叙述正确的是( )
A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
答案 B
解析 由图像可知,反应物能量低,生成物能量高,则该反应为吸热反应。
4.化学反应常常伴随能量的变化,以下是H2与Cl2反应的能量变化示意图,下列说法正确的是( )
A.氯化氢分子的电子式:
B.该反应既是氧化还原反应又是放热反应
C.形成1 ml H—Cl键要吸收431 kJ的能量
D.反应物断键时吸收的能量大于产物形成化学键时释放的能量
答案 B
解析 HCl是共价化合物,故A项电子式错;形成化学键要放出能量,C项错;通过计算判断放出的能量大于吸收的能量,该反应为放热反应,D项错,B正确。
5.已知2SO2+O2eq \(,\s\up7(催化剂))2SO3为放热反应,对该反应的下列说法正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
答案 B
解析 判断一个反应是放热反应还是吸热反应,关键看反应物的总能量与生成物的总能量的差值。如果反应物的总能量高于生成物的总能量,反应放热,B项正确;A项和C项错误,都没有考查总能量差;放热反应只表明反应物总能量比生成物总能量高,而加热是反应的条件,两者无必然联系,许多放热反应也必须加热才能开始进行,D项错误。
考点三 能源及能源的开发利用
6.近年来,全球气候变暖给人类生存和发展带来了严峻的挑战,在此背景下,“新能源”“低碳”“节能减排”“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
A.太阳能、地热能、生物质能和核聚变能均属于“新能源”
B.“低碳”是指采用含碳量低的烃类作为燃料
C.如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想
D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
答案 B
解析 太阳能、地热能、生物质能和核聚变能均属于“新能源”,故A正确;“低碳经济”是以低能耗、低污染、低排放为基础的经济模式,低碳就是指控制二氧化碳的排放量,故B错误;从图示可知,氯化氢循环利用,排出的水无污染,符合“节能减排”思想,故C正确;让煤变成合成气,能提高能源利用率,节能减排,故D正确。
考点四 化学能与热能的转化
7.如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5 mL稀盐酸。
回答下列问题:
(1)实验中观察到的现象是_______________________________________________________。
(2)产生上述现象的原因是_______________________________________________________。
(3)写出有关反应的离子方程式:_________________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
答案 (1)镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊
(2)镁与盐酸反应生成氢气,且该反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出
(3)Mg+2H+===Mg2++H2↑、Ca2++2OH-===Ca(OH)2↓
(4)小于
解析 (1)镁和盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑烛。
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的离子方程式为:Mg+2H+===Mg2++H2↑,析出固体的离子方程式为:Ca2++2OH-===Ca(OH)2↓。
(4)当反应物的总能量高于生成物的总能量时,反应是放热反应,则MgCl2溶液和H2的总能量小于镁片和盐酸的总能量。
考点五 获取电能的途径
8.下列叙述不正确的是( )
A.用天然气火力发电时,每一步都需要化学反应来完成
B.利用太阳能等清洁能源代替化石燃料,有利于节约资源,保护环境
C.原电池反应一定为氧化还原反应
D.在火力发电时,化学能转化为热能的过程实际上是氧化还原反应发生的过程,伴随着能量的变化
答案 A
解析 火力发电的过程包括,化学能eq \(―――→,\s\up7(燃料燃烧))热能eq \(―――→,\s\up7(蒸汽轮机))机械能eq \(――→,\s\up7(发电机))电能,后两个阶段都未发生化学变化。
考点六 原电池概念及构成
9.下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.Zn+Ag2O+H2O===Zn(OH)2+2Ag
B.Pb+PbO2+2H2SO4===2PbSO4+2H2O
C.Zn+CuSO4===Cu+ZnSO4
D.C+CO2eq \(=====,\s\up7(高温))2CO
答案 D
解析 D是吸热的氧化还原反应,反应过程中吸收能量,不能设计为原电池。
10.下列关于原电池的叙述中,不正确的是( )
A.原电池的负极发生的反应是氧化反应
B.原电池的电极只能由两种不同的金属构成
C.原电池能将化学能转变为电能
D.原电池中电子流入的一极是正极
答案 B
解析 原电池的负极失去电子被氧化,发生氧化反应,A正确;构成原电池正负极的材料不一定是两种不同的金属,可能是非金属和金属,B错误;根据原电池的工作原理,原电池是将化学能转变为电能的装置,C正确;原电池放电时,电子转移的方向是从负极沿导线流向正极,所以正极为电子流入的电极,D正确。
11.下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒、蔗糖溶液
B.锌片、石墨棒、硫酸铜溶液
C.锌片、铜片、稀盐酸
D.铜片、银片、硝酸银溶液
答案 A
解析 蔗糖为非电解质。
考点七 原电池的原理及应用
12.下图是原电池示意图。当该电池工作时,下列描述不正确的是( )
A.溶液由无色逐渐变为蓝色
B.铜片表面有气泡
C.电流表指针发生偏转
D.锌是负极,其质量逐渐减小
答案 A
解析 因Zn的活泼性大于Cu,则Zn为负极,Cu为正极,Cu不能反应生成Cu2+,所以溶液不会变为蓝色,故A错误;Cu为正极,H+在Cu电极上得电子生成氢气,所以铜片表面有气泡产生,故B正确;在该原电池中,Zn失去电子、电子由Zn片经导线流向Cu片,电流表指针发生偏转,故C正确;Zn为负极,Zn失去电子生成Zn2+,其质量逐渐减小,故D正确。
13.某原电池反应的化学方程式为Fe+CuSO4===FeSO4+Cu,下列有关描述正确的是( )
A.Fe为正极
B.Cu为负极
C.负极发生还原反应
D.电解质溶液是CuSO4溶液
答案 D
解析 根据金属活动顺序表知,铁比铜活泼,结合原电池原理知,铁作负极,铜作正极,负极上电极材料失电子变成离子进入溶液,发生氧化反应,正极上,溶液中铜离子得电子生成铜单质,发生还原反应,电解质溶液是CuSO4溶液,故A、B、C错误,D正确。
14.A、B、C都是金属,B中混有C时,只有C能被盐酸溶解;A、B与稀硫酸组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B
C.C>B>A D.B>C>A
答案 C
解析 B中混有C,只有C能被盐酸溶解,根据金属活动顺序表,推出C比B活泼,A、B与稀硫酸构成原电池,A为正极,则B为负极,根据原电池工作原理,推出B比A活泼,综上所述,金属活动性大小顺序是C>B>A,故C正确。
15.如图是某同学学习原电池后整理的学习笔记,错误的是( )
A.①电子流动方向 B.②电流方向
C.③电极反应 D.④溶液中离子移动方向
答案 B
解析 锌为负极,铜为正极,电子由锌片流向铜片,A正确;电流与电子运动方向相反,则电流由铜片经导线流向锌片,B错误;锌失电子生成锌离子,H+在铜片上得电子被还原生成H2逸出,C正确;原电池工作时,阴离子移向负极,阳离子移向正极,D正确。
16.某同学为了探究原电池产生电流的过程,设计了如图实验。
(1)打开K,观察到的现象为__________________________________________________。
(2)关闭K,观察到的现象是__________________________________________________。
此电池的负极的电极反应式为________________________________________________。
总反应式为________________________________________________________________。
(3)关闭K,溶液中阳离子向________(填“Zn”或“C”)极移动,外电路中,电子流动方向是________________________________________________________________________。
答案 (1)锌棒上附着有红色固体 (2)碳棒上附着有红色固体 Zn-2e-===Zn2+ Zn+Cu2+===Zn2++Cu (3)C Zn→C(或负极→正极)
解析 (1)打开K,锌与硫酸铜接触,置换出铜,所以可以看到锌棒上附着有红色固体。(2)关闭K,形成原电池,锌作负极,碳作正极,溶液中的铜离子在碳棒上得到电子生成铜,看到碳棒上附着有红色固体;其正极反应为Cu2++2e-===Cu;负极反应为Zn-2e-===Zn2+;总反应为Zn+Cu2+===Zn2++Cu。(3)关闭K,溶液中的阳离子向正极移动,即向碳棒移动,电子从锌出来经过导线流向碳。
考点八 原电池原理应用
17.某原电池总反应的离子方程式是:Zn+Cu2+===Zn2++Cu,利用该反应设计成原电池。则该电池的正极、负极和电解质溶液依次是( )
A.Zn、Cu、ZnSO4 B.Zn、Cu、CuCl2
C.Cu、Zn、ZnCl2 D.Cu、Zn、CuSO4
答案 D
解析 锌失电子发生氧化反应而作负极,不如锌活泼的金属或导电的非金属作正极(石墨),铜离子在正极上得电子发生还原反应,则电解质为可溶性的铜盐,符合条件的是D,故答案为D。
18.如图为锌、铜水果电池装置示意图,下列说法正确的是( )
A.铜片为负极,发生还原反应
B.锌片上发生还原反应:Zn-2e-===Zn2+
C.该装置将电能转变为化学能
D.电子由锌片沿导线流向铜极
答案 D
解析 原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子由负极经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌的金属性强于铜,锌是负极,铜是正极,A错误;锌片是负极,发生氧化反应:Zn-2e-===Zn2+,B错误;该装置是原电池,将化学能转变为电能,C错误;电子由负极锌片沿导线流向正极铜极,D正确。
考点九 化学电源
19.下列电池不属于二次电池(可充电电池)的是( )
答案 A
解析 铅蓄电池、镍镉电池、锂离子电池等可以反复充电放电属于可充电电池,是二次电池;碱性锌锰电池不能充电,完全放电后不能再使用,是一次电池;答案选A。
20.下列有关电池的叙述正确的是( )
A.氢氧燃料电池属于环境友好型电池,能量转化率可达100%
B.锌锰干电池是一种常用的二次电池
C.锌锰干电池工作一段时间后锌外壳逐渐变薄
D.铅蓄电池负极是PbO2,正极是Pb
答案 C
解析 燃料电池转化率不可能为100%,故A错误;锌锰干电池是一种常用的一次电池,故B错误;锌锰干电池工作过程中,负极反应为:Zn-2e-===Zn2+,锌外壳不断被腐蚀而逐渐变薄,故C正确;铅蓄电池负极是Pb,正极是PbO2,故D错误;答案选C。
21.随着人们生活质量的不断提高,废电池必须进行集中处理的问题日益得到重视,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
答案 B
解析 回收废电池的首要原因是防止废电池中渗漏出的重金属离子对土壤和水源的污染,而对废电池的综合利用是第二位的,故选B。
22.下列关于充电电池的叙述,不正确的是( )
A.充电电池的化学反应原理是氧化还原反应
B.充电电池可以无限制的充电放电
C.充电是使放电时的氧化还原反应逆向进行
D.较长时间不使用电池时,最好将电池取出并妥善存放
答案 B
解析 充电电池理论上是可以永久重复利用的,但在实际应用中总会因为性能等原因而使电解质溶液或者电极变质而失效。所以实际情况下充电电池是不能无限制重复使用的。
23.下列说法正确的是( )
A.锌锰电池和碱性锌锰电池的正极材料均是锌
B.锌锰电池中电解质主要是NH4Cl,而碱性锌锰电池中的电解质主要是KOH
C.碱性锌锰电池不如锌锰电池的寿命长
D.干电池放电之后还可再充电
答案 B
解析 Zn失电子作负极,所以锌锰电池和碱性锌锰电池的负极材料均是锌,故A错误;锌锰电池中电解质主要是NH4Cl,碱性锌锰电池中的电解质是用强碱代替了氯化铵,一般碱性锌锰电池中的电解质主要是KOH,故B正确;锌锰电池的负极为锌筒,NH4Cl溶液水解显酸性,所以锌易被NH4Cl溶液腐蚀,因此碱性锌锰电池比锌锰电池的寿命长,故C错误;干电池属于一次电池,一次电池不能反复充放电,故D错误。故选B。
24.汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O。根据此反应判断下列叙述中正确的是( )
A.PbO2是电池的负极B.Pb是负极
C.PbO2得电子,被氧化D.电池放电时,溶液酸性增强
答案 B
解析 根据电池反应知放电过程中铅失去电子,因此它是原电池的负极,其电极反应式为Pb+SOeq \\al(2-,4)-2e-===PbSO4,故B项正确;PbO2在放电过程中得到电子被还原,所以它是原电池的正极,因此A、C两项错误;由于原电池放电的过程中消耗硫酸,所以溶液的酸性减弱,故D项错误。
25.Zn—MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填字母)。
A.NaOH B.Zn
C.Fe D.NH3·H2O
(3)此废旧电池的处理方法是回收,目的是为了____________________________________。
(4)该电池的负极反应式为______________________________________________________。
答案 (1)Zn(或锌) 正极 (2)锌与还原出的铜形成铜锌原电池而加快锌的腐蚀 B (3)防止电解液污染土壤、避免金属材料的浪费 (4)Zn-2e-===Zn2+
解析 (1)负极上是失电子的,则Zn失电子为负极,电子由负极流向正极。(2)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。题目中A和D选项不能除去杂质离子,C项会引入新杂质,所以应选Zn将Cu2+置换为单质而除去。(3)锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害,此废旧电池的处理方法是回收,目的是为了防止电解液污染土壤、避免金属材料的浪费。(4)该电池的负极材料是Zn,负极上是失电子,负极反应方程式为Zn-2e-===Zn2+。
宏观解释
放热 反应示意图
吸热 反应示意图
化学反应 放出热量
化学反应 吸收热量
放热反应
吸热反应
形成原因
反应物具有的总能量 大于 生成物具有的总能量
反应物具有的总能量 小于 生成物具有的总能量
与化学键强弱的关系
生成物分子成键时释放的总能量 大于 反应物分子断键时吸收的总能量
生成物分子成键时释放的总能量 小于 反应物分子断键时吸收的总能量
反应过程图示
示例
①金属与水或酸的反应 ②燃烧反应
③中和反应 ④大部分化合反应
①Ba(OH)2·8H2O与NH4Cl反应
②C与H2O(g)、CO2的反应 ③大部分分解反应
(寒假班)人教版高中化学必修第二册同步讲义第五章化工生产中的重要非金属元素第一节 硫及其化合物(含详解): 这是一份(寒假班)人教版高中化学必修第二册同步讲义第五章化工生产中的重要非金属元素第一节 硫及其化合物(含详解),共12页。
(寒假班)人教版高中化学必修第二册同步讲义第七章有机化合物第一节 认识有机化合物(含详解): 这是一份(寒假班)人教版高中化学必修第二册同步讲义第七章有机化合物第一节 认识有机化合物(含详解),共11页。
(寒假班)人教版高中化学必修第二册同步讲义第七章有机化合物第三节 乙醇与乙酸(含详解): 这是一份(寒假班)人教版高中化学必修第二册同步讲义第七章有机化合物第三节 乙醇与乙酸(含详解),共13页。












