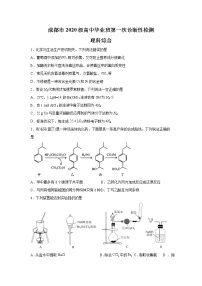

四川省成都市2023届高三第一次诊断性检测理科综合化学试题(含解析)
展开成都市2020级高中毕业班第一次诊断性检测
理科综合
1.化学与生活生产密切相关。下列说法错误的是
A.葡萄酒中添加的既可杀菌,又可防止营养成分被氧化
B.加酶洗衣粉不宜洗涤真丝织品,会使真丝中的蛋白质变性
C.常见无机含氯消毒剂有氯气、次氯酸盐、等
D.不锈钢是一种含合金元素和的合金钢
2.假设NA代表阿伏加德罗常数值。下列说法一定正确的是
A.25℃,1 LpH=14的Ba(OH)2溶液含有OH-为NA个
B.含1 mol AlCl3的溶液中离子总数目为4NA
C.32 g Cu与足量浓硝酸反应得到的气体分子总数为NA
D.标准状况下,每生成22.4 LO2转移电子数为4NA
3.布洛芬(图丁)是一种非甾体抗炎药,下面是其一条高产率的合成路线。下列说法正确的是
A.甲中最多有8个碳原子共平面 B.乙转化为丙为加成反应或还原反应
C.与丙有相同官能团的同分异构体只有6种 D.丁与乙酸互为同系物
4.下列装置能达到实验目的的是
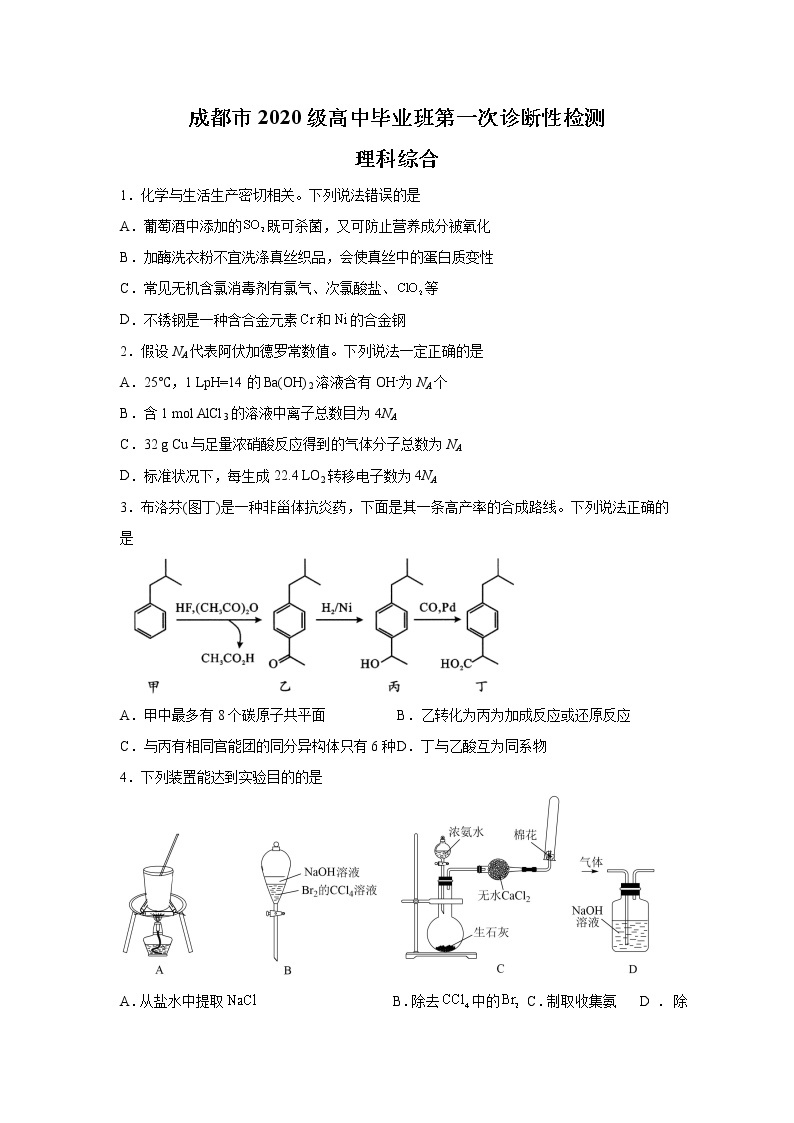
A.从盐水中提取 B.除去中的 C.制取收集氨 D.除去中的
5.短周期主族元素Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族。X、Y、Z最外层电子数分别为x、y、z,且依次增大,x、y、z之和为15,。下列说法正确的是
A.Q是原子半径最小的元素 B.最高正价含氧酸的酸性:
C.分子中各原子最外层达到8电子结构 D.Z的氢化物不可能含有非极性共价键
6.某种电催化法以为催化电极合成腈类化合物和偶氮化合物,装置示意图如图。下列说法错误的是
A.左侧电极的电势比右侧的高,且发生氧化反应
B.阴极发生反应:
C.从右侧经过阴离子交换膜向左侧移动
D.每当合成得到,同时合成
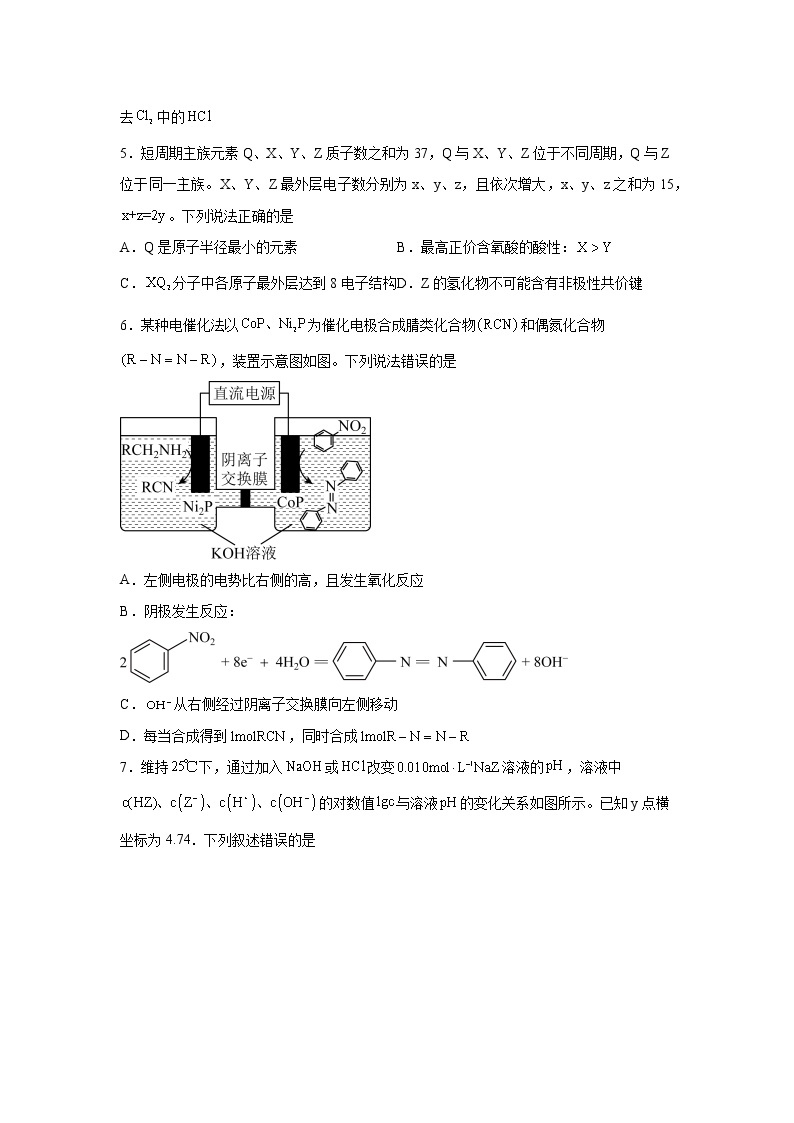
7.维持下,通过加入或改变溶液的,溶液中的对数值与溶液的变化关系如图所示。已知y点横坐标为4.74.下列叙述错误的是
A.一元弱酸电离常数为
B.溶液的约等于8.37
C.x点纵坐标为,且此时溶液中
D.图中所示各溶液均满足
8.工业上用电解溶液生成的氯气为原料,生产溴酸钾的工艺流程如下:
回答下列问题:
(1)惰性电极电解溶液产生氯气总反应的离子方程式为______________。
(2)“合成I”中得到,该反应的还原剂是______________;“合成II”中加入的目的是____________。
(3)结合溶解度曲线分析,“合成Ⅲ”为复分解反应,该反应能发生的原因是____________;若向溶液中加入______________粉末,可使溶液中的降为[假设溶液体积不变,已知该温度下]。“合成III”实际中用饱和溶液而不用粉末的优点是______________(写一条)。
(4)为了从过滤II后的滤液中获得氯化镁结晶,依次要经过________、___________操作。
(5)另一种产生溴酸盐的方法是用溶液吸收,同时生成气体。写出相应的化学方程式______________;原子经济性更高的是______________(填“吸收法”或“氯气氧化法”)。
9.镀锌钢构件的酸洗废液中含有盐酸、和。实验室从酸洗废液中回收盐酸和的实验流程如下:
已知化合物的溶解度(水)数据如下表:
物质
49.7
59.0
62.5
66.7
70.0
78.3
88.7
94.9
342
363
395
437
452
488
541
614
回答下列问题:
I.回收盐酸和粗产品
(1)操作1应选择______________(填字母序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得粗产品,应适时停止加热且留有少量残余液,这样做除了防止被氧化外,另一目的是___________;若留有残余液过多,会造成的不良后果是___________(答一条)。
II.粗产品的重结晶
(3)检验粗产品中含有的操作方法是____________。
(4)重结晶前加入的物质X为_____________;操作2的名称是______________。
III.滴定亚铁离子,测定晶体纯度
准确称取重结晶后的晶体,溶于混酸中并定容至。移取三份溶液,加入指示剂,用标准溶液()滴定至终点,半分钟内不恢复,平均消耗标准溶液体积为(此时不被氧化)。
(5)计算晶体的纯度为____________(含a、c的代数式,化到最简)。
10.直接将转化为有机物并非植物的“专利”,科学家通过多种途径实现了合成甲醛,总反应为.转化步骤如图1所示:
(1)原料可通过捕捉技术从空气中或工业尾气中获取,写出一种常见的可作捕捉剂的廉价试剂___________。
(2)已知,则总反应的___________(用图1中焓变以及表示)。
(3),在容积为的恒容密闭容器中充入和一定量,只发生可逆反应①。若起始时容器内气体压强为,达到平衡时,的分压与起始投料比的变化关系如图2所示。
(ⅰ)若时到达c点,则时的平均反应速率________;
(ⅱ)__________(写计算表达式);
(ⅲ)c点时,再加入和,使两者分压均增大的转化率_____________(填“增大”、“不变”或“减小”)。
(4)在恒温恒容条件下只发生反应②。关于该步骤的下列说法错误的是____________。
A.若反应②正向为自发反应,需满足
B.若气体的平均相对分子质量保持不变,说明反应②体系已经达到平衡
C.增大的浓度,的平衡物质的量分数一定增大
D.反应②体系存在
(5)已知Arrhenius公式:(为活化能,k为速率常数,R和C为常数)。反应①②的有关数据分别如图3所示,相对较小的是___________;研究表明,加入某极性介质有助于加快整个反应的合成速率,原因可能是___________。
[化学选修3:物质结构与性质](15分)
11.含银卤化物胶片是摄影中常用的感光材料。回答下列问题:
(1)卤化银曝光后会产生(黑色粉末)和。基态原子的价电子排布式为___________。
(2)加入显影剂(如等),使潜影银核中的进一步还原为。中(除H外)其他所含元素的第二电离能最大的是___________;该物质能溶于冷水,原因是_____________。
(3)用溶解胶片上多余的,形成可溶的直线形配离子,从而定影.离子的VSEPR模型为___________,中中心的杂化轨道类型为___________,其中配位时给出孤电子对能力较强的是___________(填“S”或“O”)。
(4)电解法可回收银单质。单质为面心立方最密堆积,晶胞参数为,则银原子的半径__________。
(5)晶胞如右图,晶胞参数为。晶体中的配位数为___________;已知离子半径为,离子之间不相切,则晶体中离子半径_____________。
[化学选修5:有机化学基础](15分)
12.肌肉松弛剂Nefopam的合成路线如下所示(表示苯环)。
回答下列问题:
(1)A中的__________(填名称)官能团会被还原,还原后经“反应2”形成B的反应类型是___________。
(2)B与反应得到__________种一元溴代产物;为了使B转化为C的原子利用率为,合适的试剂X是______________。
(3)已知碳原子上连有4个不同的原子或基团时,该碳称为手性碳,D分子具有___________个手性碳;一定条件下与足量水溶液反应,最多消耗____________。
(4)中间产物E分子内环化生成。写出产物F的结构简式_____________。
(5)参考上述合成路线,F经____________(填“”或“”)还原以及酸处理形成Nefopam.
(6)写出符合下列条件的B的同分异构体____________(任写一个)。
①能发生银镜反应;②其水解产物之一能与溶液显色;③含有两个苯环和一个五元环。
1.B
【详解】
A.SO2可以抑制细菌生长,也具有还原性,在葡萄酒中可以杀菌,也可用于防氧化,A正确;
B.真丝织品的主要成分是蛋白质,加酶洗衣粉不宜洗涤真丝织品,是因为酶使真丝中的蛋白质水解,B错误;
C.常见无机含氯消毒剂有氯气、次氯酸盐、 ClO2 等,C正确;
D.不锈钢主要含有Fe、Cr、Ni和少量的碳,D正确;
故选B。
2.A
【详解】
A.25℃,Kw=10-14,1 LpH=14的Ba(OH)2溶液中n(OH-)=1 mol,则其中含有OH-为NA个,A正确;
B.溶液中还存在水电离出的氢离子和氢氧根离子,不能计算离子数目,B错误;
C.32 g Cu的物质的量是0.5 mol,其与足量浓硝酸发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,根据方程式中物质反应转化关系可知0.5 mol Cu反应产生1 mol NO2气体,但可能有部分NO2溶解在溶液中,发生反应:3NO2+H2O=2HNO3+NO,则反应得到的气体分子总数可能小于NA,C错误;
D.在标准状况下,22.4 LO2的物质的量是1 mol,由于不确定制取O2的方法,因此不能根据反应制取O2的物质的量确定反应过程中转移电子数目,D错误;
故合理选项是A。
3.B
【详解】
A.甲中苯环上的6个碳原子共平面,和苯环直接相连的碳原子也共平面,以该碳原子为中心,取代基上与该碳原子直接相连的碳原子与其共面,以此类推,取代基上还有一个碳原子与它们共面,所以总共是6+1+1+1=9,所以最多有9个碳原子共平面,A选项错误;
B.乙转化为丙是在催化剂的作用下,碳氧双键与氢气发生加成反应生成,是加成反应或还原反应,B选项正确;
C.与丙有相同官能团即含有-OH,除了苯环外,取代基有6个C原子,并且可以是一取代、二取代、三取代等取代方式,所以同分异构体种类远远超过6种,C选项错误;
D.丁的分子式为,乙酸的分子式为C2H4O2,分子组成上并不是相差n个-CH2-,故不互为同系物,D选项错误;
答案选B。
4.B
【详解】
A.盐水中提取NaCl,用蒸发结晶的方法,需要用蒸发皿,坩埚是用于灼烧的,A错误;
B.Br2能与NaOH反应,且NaOH溶液与CCl4不互溶,所以可以用NaOH除去Br2后,再用分液的方法将NaOH溶液与CCl4分离,B正确;
C.浓氨水与生石灰混合,生石灰溶于水放热且生成氢氧化钙,使一水合氨的电离平衡往逆向移动,从而产生氨气,氨气会与氯化钙反应,不能用无水氯化钙干燥,C错误;
D.Cl2也可以与NaOH反应,用NaOH除去HCl,也会将Cl2除掉,D错误;
故选B。
5.C
【分析】
由题意,x、y、z之和为15,,可推知y=5,x=3或4,z=7或6,又由Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族,可推出X为C,Y为N,Z为O,Q为S。
【详解】
A.根据元素周期律,同周期元素,原子序数越大,原子半径越小;同主族元素,原子序数越大,原子半径越大,得Z是原子半径最小的元素,故A错误;
B.同周期元素的非金属性随原子序数增大而递增,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性X
D.Z的氢化物有H2O和H2O2两种,H2O2分子中既含有极性共价键又含有非极性共价键,故D错误;
故答案选C。
6.D
【详解】
A.右侧电极硝基苯发生还原反应,右侧为阴极、左侧为阳极,所以左侧电极的电势比右侧的高,且发生氧化反应,故A正确;
B.右侧电极硝基苯发生还原反应,右侧为阴极,阴极发生反应为 ,故B正确;
C.右侧为阴极、左侧为阳极,从右侧经过阴离子交换膜向左侧移动,故C正确;
D.阳极反应式为,R-CH2NH2-4e-+4OH-=R-CN+4H2O,根据得失电子守恒,每当合成得到,同时合成,故D错误;
选D。
7.D
【分析】
根据题意,溶液中存在水解平衡Z-+H2OHZ+OH-,随着pH增大,增大,则lgc(OH-)增大,d为,减少,则lgc(H+)减小,a为,b为,c为,据此分析解题。
【详解】
A.,取y点计算, =, =,A正确;
B.根据水解平衡Z-+H2OHZ+OH-,可知,,,溶液的约等于8.37,B正确;
C.x点纵坐标为,沿着x点作一条横坐标的垂线,可得与c点的交点大于与d点的交点,且此时溶液中,C正确;
D.当溶质仅为NaZ时存在物料守恒,,若加入NaOH,改变,体系中不成立,D错误;
答案选D。
8.(1)
(2) 与反应得到溴酸根离子,在合成Ⅲ中更多地生成溴酸钾与氯化镁分离,提高的纯度
(3) 反应体系中溶解度较小,析出沉淀 1.08 用饱和溶液沉淀速率更快或转化率(利用率)更高
(4) 蒸发结晶 趁热过滤
(5) 氯气氧化法
【分析】
工业上用电解饱和食盐水生成氯气生产溴酸钾的工艺流程,分析流程可知,饱和食盐水电解生成氯气具有氧化性,在水中和溴单质反应生成溴酸和氯化氢,加入过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,过滤得到滤液中加入饱和氯化钾溶液,溴酸镁在饱和溶液中析出晶体,以此解答。
【详解】
(1)用惰性电极电解 MgCl2溶液过程中,阳极2Cl--2e-=Cl2↑ 阴极2H2O+2e-+Mg2+=H2↑+ Mg(OH)2↓, 总反应的离子方程式为。
(2)“合成I”发生反应是氯气在水溶液中氧化溴单质为溴酸,反应的化学方程式5Cl2+Br2+6H2O=2HBrO3+10HCl,Br元素化合价上升,该反应的还原剂是;依据流程分析可知,加入和溶液中反应得到溴酸根离子,在合成Ⅲ中更多地生成溴酸钾与氯化镁分离,提高的纯度。
(3)过量氧化镁和盐酸溴酸反应生成氯化镁和溴酸镁,加入饱和氯化钾溶液,反应体系中溶解度较小,析出沉淀,发生了复分解反应;降为时,即需要沉淀2×0.15mol/L×2-2×0.1mol/L=0.4mol,需要消耗0.4molKCl,此时溶液中剩余c(K+)=,需要加入KCl的物质的量n(K+)=0.34mol/L×2L+0.4mol=1.08mol;“合成III”实际中用饱和溶液而不用粉末的优点是:用饱和溶液沉淀速率更快或转化率(利用率)更高。
(4)氯化镁的溶解度随温度变化较大,可以通过重结晶的方法从溶液中获得氯化镁结晶,依次要经过蒸发结晶、冷却结晶操作。
(5)和反应生成、和KBr,Br元素化合价由0价上升到+5价,又由0价下降到-1价,根据得失电子守恒和原子守恒配平方程式为: ;该方法中部分转化为KBr,氯气氧化法中全部转化为,所以原子经济性更高的是氯气氧化法。
9.(1)B C
(2) 防止结晶水水量偏低 造成析出的晶体过少,甚至无晶体析出或盐酸回收不充分
(3)取少量粗产品样品,加入少量无氧水溶解,滴加溶液显红色
(4) 粉 过滤
(5)
【分析】
酸洗废液中含有盐酸、氯化亚铁和氯化锌,操作Ⅰ为蒸馏,溜出液为HCl,残余液中有氯化锌和氯化亚铁,冰水浴冷却抽滤得到氯化亚铁的粗产品,加入盐酸和Fe,加入盐酸防止FeCl2在结晶过程中水解,加入Fe防止Fe2+被氧化,操作2为过滤,干燥最终得到氯化亚铁晶体。
【详解】
(1)操作1为蒸馏,温度为150℃,水浴无法达到150℃,因此应该选择油浴加热,油浴需要加入沸石,答案选BC。
(2)为了获得粗产品,应适时停止加热且留有少量残余液,这样做除了防止被氧化外,另一目的是防止FeCl2·4H2O结晶水水量偏低。若留有残余液过多,会导致析出的FeCl2·4H2O晶体过少,甚至无晶体析出或盐酸回收不充分。
(3)检验氯化铁晶体中是否含有Fe3+的操作方法为取少量粗产品样品,加入少量无氧水溶解,滴加溶液,若溶液显红色,说明其中含有铁离子反之则无。
(4)结晶前需要加入的物质X为铁粉,用途为防止Fe2+被氧化,操作2的名称为过滤。
(5)K2Cr2O7与亚铁离子反应离子方程式为6Fe2+++14H+=6Fe3++2Cr3++7H2O,消耗的物质的量为cV×10-3mol,则消耗Fe2+的物质的量为6cV×10-3mol,则ag样品中含有Fe2+2.4cV×10-2mol,则FeCl2·4H2O晶体的纯度为%
10.(1)溶液或氨水或石灰乳
(2)
(3) 0.18 增大
(4)C
(5) 反应② 极性介质使反应①的活化能降低
【分析】
总反应可以根据盖斯定律计算出该反应的活化能;根据平衡常数的表达数能计算出用分压表示平衡常数,根据了勒夏特列原理分析平衡移动的情况;根据反应的活化能和速率成反比,可以根据反应的活化能判断反应速率的相对大小。
【详解】
(1)能与CO2反应的,均可以作为CO2捕获剂,一般选择碱性物质,结合题目要求需要选择廉价并常见的试剂,可以是溶液或氨水或石灰乳;
(2)根据图1及盖斯定律,总反应是①+②+③-④得到的,则反应热 ;
(3)根据图1反应① 为:
i.起始时容器内气体的总压强为1.2kPa,若5min时反应到达c点,c点CH3OH的物质的量为x,,x=0.6mol,则反应消耗氢气的物质的量为1.8mol,v(H2)==0.18mol/(L·min);
ii.b点和c点在同一温度下,所以b点平衡常数与c点一样,根据c点数据列三段式:
甲醇压强为0.24kPa,则二氧化碳的压强为0.16kPa、氢气的压强为0.08kPa、水蒸气的压强为0.24kPa,b点时反应的平衡常数Kp=;
iii.c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05kPa,Qc=
A.若反应②正向为自发反应,则说明,该反应是气体分子数减小的反应,故△S<0,需满足才能自发进行,A正确;
B.该反应随着反应的进行,气体质量一直在减小,反应是气体分子数减小的反应,则物质的量一直在减小,则气体平均摩尔质量不变不能确定是否达到平衡,故B错误;
C.增大的浓度,平衡往正向移动,则的平衡物质的量分数一定增大,C正确;
D.反应②中H2O2是纯液体,D错误;
故选C。
(5)根据图示,反应②的斜率比反应①小,根据公式,斜率即Ea的大小,所以活化能较小的是反应②;总反应的决速步骤一般是反应速率较慢的那个反应,加入某极性介质有助于加快整个反应的合成速率,根据图示分析,反应速率较慢的是反应①,所以可能是极性介质使反应①的活化能降低,从而加快了总反应的速率。
11.(1)
(2) O 一方面该分子具有极性,与水相似相溶,另一方面可与水形成分子间氢键
(3) 四面体(形) sp s
(4)
(5) 6
【详解】
(1)基态原子为35号元素,故价电子排布式为。
(2)O、N、C原子失去1个电子后的价电子排布式为2s22p3、2s22p2、2s22p1,此时O的2p上处于半满状态,较稳定,再失去一个电子需要更高的能量,故第二电离能最大;一方面该分子为极性分子,易溶于同为极性分子的水中,另一方面可与水形成分子间氢键,故该物质能溶于冷水。
(3)与SO互为等电子体,故成键和结构相似,故VSEPR模型为四面体(形);中中心形成2个配位键,故杂化轨道类型为sp杂化,S的电负性比O小,故S提供孤电子对。
(4)单质为面心立方最密堆积,故面对角线上的3个Ag原子相切,面对角线长度为pm=4r1,故pm。
(5)如图所示,以体心处Ag+为对象,则距离最近的Cl-位于6个面心,晶体中的配位数为6。边长apm=2bpm+2r2,则r2=()pm。
12.(1) (酮)羰基 酯化反应(或取代反应)
(2) 7
(3) 1 3
(4)
(5)
(6)等
【分析】
A经还原后羰基转化为醇羟基,羟基再与羧基发生酯化得到B,B与发生取代反应生成C,C在作用下脱出羰基形成D,D与发生取代反应生成E,E中氯原子与-NH-发生分子内取代反应生成F,F发生还原反应再经酸化得到Nefopam,据此分析解答。
【详解】
(1)对比A与B的结构可知A中羰基转化成单键,羰基被还原,还原后羰基转化为醇羟基,羟基再与羧基发生酯化得到B,故答案为:(酮)羰基;酯化反应(或取代反应);
(2)B与发生苯环上的取代反应,B中有两个苯环,其中Ph代表的苯环中存在三种氢,另一苯环中存在4种氢,共有7种溴代产物;为了使B转化为C的原子利用率为,结合B和C的结构对比,合适的试剂X应为,故答案为:7;;
(3)根据手性碳的概念,D中只有羟基所连碳为手性碳原子;中1molCl可消耗1molNaOH,其中ClCO-中氯原子被取代后生成-COOH,能继续消耗NaOH,因此可消耗3molNaOH,故答案为:1;3;
(4)由以上分析已知F为,故答案为:;
(5)由A到B,C到D的转化过程可知能将羰基直接脱氧,因此F经处理才能得到Nefopam,故答案为:;
(6)①能发生银镜反应,可知存在醛基或甲酸酯基结构;②其水解产物之一能与溶液显色,可知存在酯基,结合氧原子个数,及发生银镜反应,可知存在甲酸酯基,且甲酸酯基结构直接与苯环相连才能水解出酚类结构;③含有两个苯环和一个五元环,符合的结构有:等,故答案为:等;
四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题(含解析): 这是一份四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题(含解析),共20页。试卷主要包含了单选题,实验题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题(含解析): 这是一份四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题(含解析),共17页。试卷主要包含了选择题等内容,欢迎下载使用。
四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题(含解析): 这是一份四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题(含解析),共17页。试卷主要包含了选择题等内容,欢迎下载使用。