

福建省连城县第一中学2023届高三化学上学期月考二试卷(Word版附答案)
展开连城一中2022-2023学年上期高三年级月考二化学试题
满分100分 考试时间75分钟
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共100分,考试时间75分钟.
可能用到的相对原子质量:H - 1 C - 12 N-14 O -16 P-31 Ca-40 I-127
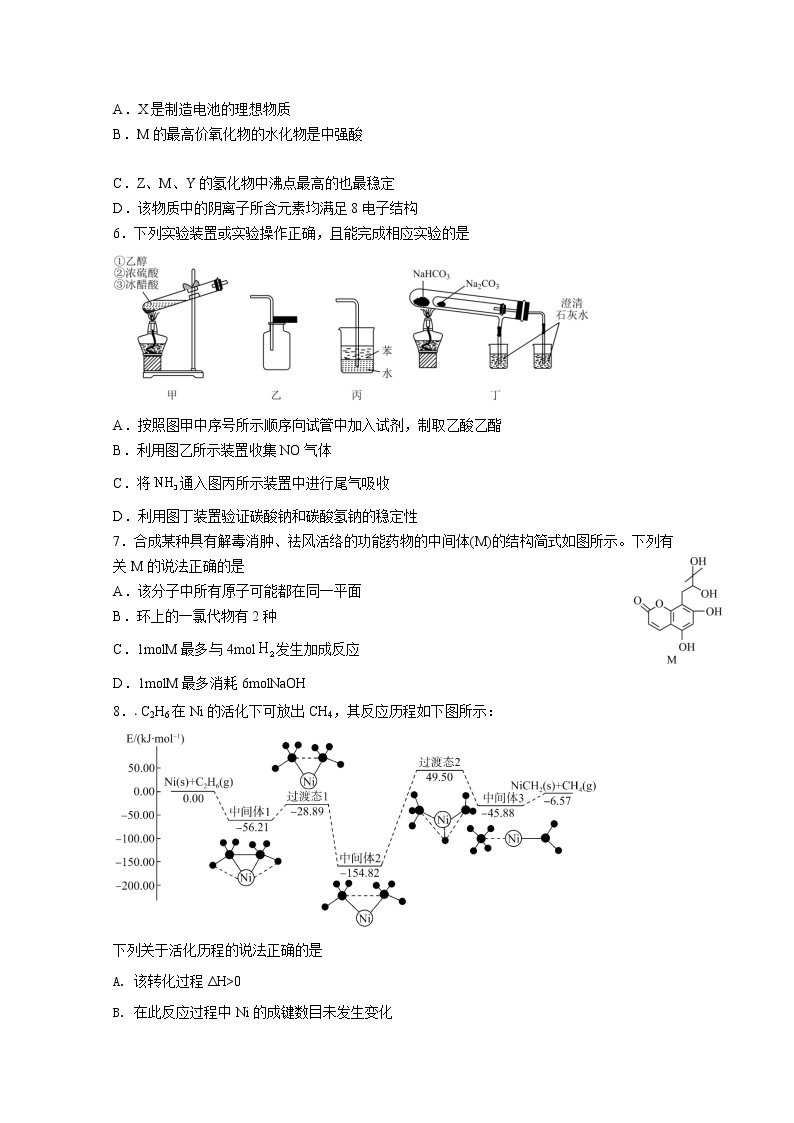
第Ⅰ卷(选择题,共40分)
一、选择题:(本题共10小题,每小题4分,共40分。每小题只有一个选项符合题意。)
1.从科技前沿到日常生活,化学无处不在。下列说法错误的是
A. 在三星堆“祭祀坑”提取到丝绸制品残留物,其中丝绸主要成分为蛋白质
B. 2022年北京冬奥会吉祥物“冰墩墩”使用聚乙烯属于高分子材料
C. “天和”核心舱中使用的氮化硼陶瓷基复合材料属于高分子材料
D. “空气捕捉”法能实现从空气中捕获二氧化碳,利于碳达峰、碳中和
2.反应COCl2+4NH3=CO(NH2)2+2NH4Cl可去除COCl2污染。下列说法正确的是
A.COCl2是极性分子 B.NH3的电子式为
C.CO(NH2)2含离子键和共价键 D.NH3的空间构型为平面三角形
3.NA是阿伏加德罗常数的值。下列说法正确的是
A.31g白磷(P4)含有的共价键数为3NA
B.0.1mol/LHClO4溶液中含有的H+数为0.1NA
C.2molNO与 1molO2在密闭容器中充分反应后的分子数为2NA
D.标准状况下11.2LCH4和22.4LCl2混合,在光照下反应后的分子总数为1.5NA
4.宏观辨识与微观探析是化学学科核心素养之一,下列方程式能准确解释相应事实的是
A.苯酚钠溶液通入后变浑浊:2+CO2+H2O→2+Na2CO3
B.向FeSO4溶液中加入NH4HCO3溶液得到FeCO3沉淀:Fe2++2=FeCO3↓+CO2↑+H2O
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO+3Cl-+H2O+4H+
D.向溶液中加入足量溶液,得到白色沉淀:
5.近日,南方科技大学某课题组在一定条件下通过电解M元素的某种单质获得了一种新化合物(结构如下图所示),其中X、Y、Z、M为原子序数依次增大的短周期主族元素,在元素周期表中元素Z与Y、M相邻。下列叙述不正确的是( )
A.X是制造电池的理想物质
B.M的最高价氧化物的水化物是中强酸
C.Z、M、Y的氢化物中沸点最高的也最稳定
D.该物质中的阴离子所含元素均满足8电子结构
6.下列实验装置或实验操作正确,且能完成相应实验的是
A.按照图甲中序号所示顺序向试管中加入试剂,制取乙酸乙酯
B.利用图乙所示装置收集NO气体
C.将通入图丙所示装置中进行尾气吸收
D.利用图丁装置验证碳酸钠和碳酸氢钠的稳定性
7.合成某种具有解毒消肿、祛风活络的功能药物的中间体(M)的结构简式如图所示。下列有关M的说法正确的是
A.该分子中所有原子可能都在同一平面
B.环上的一氯代物有2种
C.1molM最多与4mol发生加成反应
D.1molM最多消耗6molNaOH
8.. C2H6在Ni的活化下可放出CH4,其反应历程如下图所示:
下列关于活化历程的说法正确的是
A. 该转化过程ΔH>0
B. 在此反应过程中Ni的成键数目未发生变化
C. 该反应过程中,最大能垒(活化能)为204.32kJ·mol-1
D. 整个过程中,Ni是该反应的催化剂
9.硫酸钾是一种重要的无氯优质钾肥,利用某高钾明矾石制备硫酸钾的工艺流程如下:
已知:高钾明矾石的主要成分为和少量。下列说法正确的是
A.焙烧时反应的化学方程式为
B.调节pH的目的是使和完全沉淀
C.化合物Y可制成铝热剂用于焊接铁轨
D.可回收利用后应用于本流程
10.在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应:mA+nBpC,保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
压强p/Pa | 2×105 | 5×105 | 1×106 | 3×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.40 | 0.80 |
下列说法一定正确的是( )
A.保持一定温度,增大压强,平衡正向移动
B.当压强为3×106Pa时,此反应的平衡常数表达式:Kp=
C.反应平衡后若增大压强,则新平衡的逆反应速率大于原平衡的逆反应速率
D.若再向体系中加入bmolB,当重新达到平衡时,体系中A、B、C总物质的量为(4+b)mol
第Ⅱ卷(非选择题,共60分)
二、填空题(共5小题)
11.(13分,除标注1分,其余每空2分。)高品质可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料采用“两矿一步浸出法”制备高品质的某工艺流程如图所示:
已知:①软锰矿与黄铁矿的主要成分分别为、,还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
金属离子 | |||||
开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全()的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
回答下列问题:
(1)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是 。(1分)
(2)“酸浸”操作中需先后分批加入、。加入后发生酸浸过程的主要反应离子方程式为,。
①已知滤渣1的主要成分为S、、等,其附着在矿粉颗粒表面使上述反应受阻,此时加入,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致迅速分解的因素是
。
②矿粉颗粒表面附着物被破除后,还可以继续与反应,从而提高锰元素的浸出率,该反应的离子方程式是 。
(3)“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为 (填化学式)。
(4)“除杂”时,溶液体系中的和形成氟化物沉淀。若沉淀后上层清液中,则 [已知]。
(5)“沉锰”步骤发生主要反应的离子方程式为 。
(6)利用惰性电极电解体系获得的机理(部分)如图甲所示,硫酸浓度与电流效率的关系如图乙所示。硫酸浓度超过时,电流效率降低的原因是
12.(13分,除标注3分,其余每空2分) 乳酸亚铁固体{,相对分子质量234}易溶于水,难溶于乙醇,常用于治疗缺铁性贫血。可由乳酸与反应制得。回答下列问题:
I.制备碳酸亚铁
①组装仪器,检查装置气密性,加入试剂;
②先关闭,打开、。
③一段时间后,关闭活塞,打开活塞;
④抽滤,洗涤干燥。
(1)装置a可盛适量的水,其作用是___ ________。
(2)可用溶液代替溶液制备碳酸亚铁,
发生反应的离子方程式为__ __ __(3分)
此法所得产品纯度更高,原因是__ _____。
II.乳酸亚铁晶体纯度的测量
(3)若用滴定法测定样品中的量进而计算纯度时,发现结果总是大于100%,
其原因是___ _ ___。
(4)该兴趣小组改用铈(Ce)量法测定产品中的含量,可通过用滴定法测定样品中的含最来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为)。称取7.8g样品配制成250.00mL溶液,取25.00mL用0.10标准溶液滴定。反复滴定2~3次,平均消耗标准液30.00mL,则产品中乳酸亚铁晶体的纯度为_______。若滴定操作时间过长,
则样品纯度将____ ___(填“偏大”“偏小”或“不变”)。
13.(14分) I.氢气是一种清洁能源,水煤气变换反应的制氢原理为:,回答下列问题:
(1)水煤气变换部分基元反应如下:
基元反应 | 活化能Ea(eV) | 反应热△H(eV) |
① | 0 | -1.73 |
② | 0.81 | -0.41 |
第②步基元反应逆反应的活化能为___________eV。
(2)某研究所探究CuO/的系列催化剂(包括C/Z-120、C/Z-250、C/Z-350、C/Z-450)在水煤气变换反应中的催化活性。常压下,原料气在不同温度下相同时间内CO的转化率如图:
①工业生产中应选择的最佳反应条件为___________。
②C/Z-120曲线先上升后下降的原因___________
II.长征运载火箭推进剂为和。
(3)在t℃、pMPa下,将(g)和物质的量分数为m%的(g)通入反应器:①,②,一段时间后完全反应,反应②达平衡,与的体积比为1:2,则反应②的平衡常数___________MPa。
(4)T℃时,,该反应正、逆反应速率与浓度的关系为:,(、这是速率常数)。
①图中表示的线是___________(填“m”或“n”)
②T℃时,向刚性容器中充入一定量气体,平衡后测得为1.0,则平衡时,=________(用含a的表达式表示)。
③T℃时,向2L的容器中充入5mol气体和1mol气体,此时______(填“>”、“<”或“=”)。
14.(10分,1,2,3每空1分,4,5,6每空2分)(2022·湖南·株洲市南方中学高三期中)化合物Ⅸ是合成一种新型多靶向抗肿瘤药物的中间体,其合成路线流程图如下:
回答下列问题:
(1)写出化合物Ⅰ的名称 ,化合物Ⅰ→Ⅱ的反应类型 。
(2)化合物Ⅲ由C、H、O三种原子组成,结构简式为 。
(3)化合物Ⅳ分子结构中的含氧官能团有 (填名称)。
(4)化合物Ⅴ在酸性下水解,有一种产物能在一定条件下自身聚合形成高聚物。形成该高聚物的反应方程式为 。
(5)化合物X是V的同系物,其相对分子质量比V小28,化合物X同时满足如下条件的同分异构体有______种。
①苯环上有两种取代基,且能与溶液发生显色反应;
②能与溶液反应生成气体。
这些同分异构体中满足核磁共振氢谱峰面积比为6∶2∶2∶1∶1的结构简式 。
15.(10分,每空1分) 2022年春晚中舞蹈诗剧《只此青绿》生动还原了北宋名画,《千里江山图》之所以色彩艳丽,璀璨夺目,与所使用矿物颜料有关。回答下列问题:
(1)石青,又名蓝矿石,化学式为,基态核外电子的空间运动状态有______种,的空间构型为________。原子中电子有两种相反的自旋状态,分别用和表示,称为电子的自旋磁量子数,则中电子自旋磁量子数的代数和为________。
(2)亚铁氰化钾,化学式为,呈黄色结晶性粉末。中配体的配位原子是____(填元素符号),中C原子的杂化方式_____,中σ键和π键的数目之比为_______。
(3)呈黑色或灰黑色,已知:晶胞中的位置如图1所示,位于所构成的四面体中心,晶胞的侧视图如图2所示。
填充了晶胞中四面体空隙的百分率是______,配位数为________。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的的原子分数坐标为________。若晶胞参数anm,晶体的密度为,则阿伏加德罗常数的值为________(用含a和d的式子表示)
附加题:(10分)
1.油气开采、石油化工等行业废气普遍含有,需要回收处理并加以利用,有关反应如下:
ⅰ.
ⅱ.
ⅲ.
回答下列问题:
(1)热分解反应的 (用含“、、”的式子回答);实验测得该反应的活化能(正)大于(逆),则 0(填“<”、“>”或“=”)。
(2)热分解反应的速率方程可表示为:和,和分别为正、逆反应速率常数。T℃时,,,则该温度下热分解反应的平衡常数K= 。
(3)总压恒定为100Kp,向密闭容器中充入、、,发生反应ⅰ和反应ⅱ,反应过程中、、等含硫物质的分布分数随时间变化如图所示。
①表示分布分数的曲线为 (填“甲”、“乙”或“丙”)。
②时测得转化率为,此时体系中的物质的量为 mol;用分压表示的平均反应速率为 。
连城一中2022-2023学年上期高三年级月考二化学试题参考答案
一、 选择题(本题共10小题,每小题4分,共40分。每小题只有一个选项符合题意。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | A | D | B | C | A | C | C | D | D |
二、非选择题(本题共5小题,共60分。)
11(13分,除标注1分,其余每空2分。)
.(1)增加接触面,提高反应速率;提高原料利用率(1分)
(2) 或或等作催化剂
(3)、
(4)50
(5)
(6)硫酸浓度高,被消耗,效率降低
- (13分,除标注3分,其余每空2分)
【答案】(1)液封,防止空气进入三颈烧瓶中氧化Fe2+
(2) (3分)
原因:碳酸根离子水解呈碱性且碱性较强,反应中易生成氢氧化亚铁(或碳酸氢钠溶液碱性较弱,反应中不易生成氢氧化亚铁)
(3)乳酸根中羟基被酸性高锰酸钾溶液氧化
(4)90% 偏小
- (14分,每空2分)
【答案】(1)1.22
(2)①. C/Z-250,240℃
②. 温度升高,反应速率增大,相同时间内CO的转化率增大,但当温度较高时,C/Z-120催化剂失活,相同时间内CO的转化率降低
(3)
(4)①. n ②. 10a >
14.(10分,1,2,3每空1分,4,5,6每空2分)
【答案】(1) 4-溴苯甲酸(对溴苯甲酸) 取代反应
(2)CH≡CCH2CH2OH
(3)羟基、酯基
(4)n+(n-1)H2O
(5) 15
15.(10分,每空1分)
【答案】(1) 14 平面正方形或正四面体 或
(2) N sp 1:1
(3) 100% 8 (,,)
附加题:(10分,除标注1分,其余每空2分)
【答案】(1) (1分) >(1分)
(2)3
(3) 乙
福建省厦门市第一中学2023-2024学年高三上学期第二次月考化学试卷(Word版附答案): 这是一份福建省厦门市第一中学2023-2024学年高三上学期第二次月考化学试卷(Word版附答案),共10页。试卷主要包含了可能用到的相对原子质量,为阿伏加德罗常数的值,配合物等内容,欢迎下载使用。
福建省连城县第一中学2024届高三上学期月考(一)化学试卷(含答案): 这是一份福建省连城县第一中学2024届高三上学期月考(一)化学试卷(含答案),文件包含人教版物理八年级上册同步精品讲义24噪声及其控制原卷版doc、人教版物理八年级上册同步精品讲义24噪声及其控制教师版doc等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
福建省连城县第一中学2022-2023学年高二下学期月考(一)化学试卷(含答案): 这是一份福建省连城县第一中学2022-2023学年高二下学期月考(一)化学试卷(含答案),共12页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












