









高中化学人教版 (2019)选择性必修1第一节 化学反应速率课文配套ppt课件
展开《化学反应速率 第3课时 活化能》教学设计
一、课标解读
1.了解化学反应是有历程,认识基元反应活化能对化学反应速率的影响
2.构建简单碰撞理论.并能用简单碰撞理论说明反应条件对化学反应速率的影响(微观角度),体会理论模型的建构过程,强化模型意识
3. 结合碰撞理论,初步了解催化剂能通过改变反应历程,改变反应活化能,改变反应速率
二、教材分析
教材在学生学习了化学反应速率和外界条件对反应速率的影响之后,编排活化能课时知识,引导学生认识反应速率由感性实验到理论分析,宏观表象转入微观分析。相对旧版本教材(活化能知识和碰撞理论放在本章绪言),新教材的编排更加符合人们研究事物的一般顺序。
教材通过HI分解反应图片,结合教师引导,让学生能用比较形象的方式,构建抽象的简单的碰撞理论模型,通过思考讨论栏目,试图让学生运用简单碰撞理论,解释浓度、温度对化学反应速率的影响。使学生认识反应速率由宏观表象转入微观分析,同时也让学生体会理论模型的建构过程,强化模型认知意识。
相对旧教材而言,新教材在催化剂对反应速率的影响增加了比较大的篇幅,使学生对催化剂影响反应速率有更完整的了解。同时,催化剂通过改变反应历程改变反应活化能、改变反应速率是碰撞理论的再次运用。所以引导学生构建好碰撞理论,以及运用该模型解释外因对反应速率的影响是本节内容的主线。
三、学情分析
在本节课之前学生已能从定性和定量角度去分析对外界因素影响化学反应速率的影响,比较容易激发学生探究外界因素对反应速率影响的本质。本节课的重点是构建简单碰撞理论,在必修一学习化学键的时学生曾初步了解过碰撞理论,所以学生必较容易构建对碰撞理论。通过教师引导分析影响活化分子数的因素,按照“外界因素改变→活化分子数改变→反应速率改变”建立分析模型,学生能够突破该难点,并且能够引导学生强化模型意识。对于催化剂通过改变反应历程、改变活化能影响反应速率,由于学生对反应历程了解的非常少,且建立在抽象微观层面,学生掌握会比较困难。教师应该结合反应实例、反应历程图像、反应能量变化和碰撞理论帮助学生突破。
四、素养目标
【教学目标】
1.构建碰撞理论,运用碰撞理论解释外因对化学反应速率的影响
2.了解化学反应是有历程,了解催化剂通过改变反应历程、反应活化能改变反应速率
【评价目标】
1.能构建碰撞理论,并运用碰撞理论解释浓度、温度对反应速率的影响
2.能从改变反应历程、改变反应活化能角度了解催化剂对反应速率的影响,并认识到催化剂对化学反应的重要性
五、教学重点、难点
【重点】
构建碰撞理论,并运用碰撞理论解释浓度、温度对反应速率的影响
【难点】
催化剂对反应反应历程的改变、改变反应活化能,影响反应速率。
六、教学方法
七、教学思路
八、教学过程
环节 | 教师活动 | 学生活动 |
回顾复习 | 课件展示:增大反应物浓度、升高温度和使用催化剂如何改变反应速率。 | 回忆外因对反应速率的影响。 |
课堂导入 | 展示因研究催化剂而获的诺贝尔奖的科学家。 | 回忆催化剂相关知识。 |
建立模型 | 化学反应中反应物分子通过什么方式断键成键。 | 回忆化学键角度认知化学 |
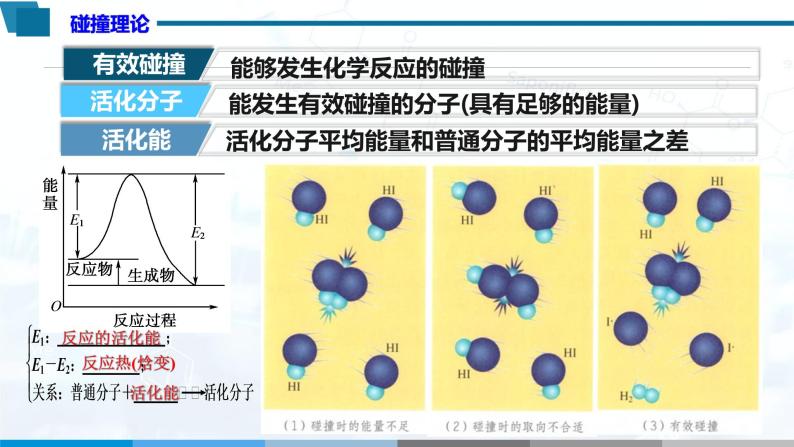
展示HI分解反应的二步基于反 | 学习相关概念 | |
通过图片解释HI分解反应碰撞过程,引入活化分子、活化能概念,建立简单碰撞理论。 | 构建简单碰撞理论 | |
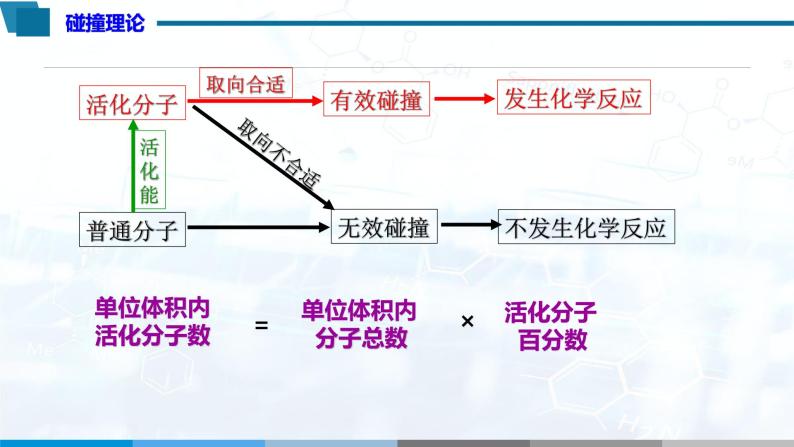
认识模型 | 引导分析影响化学反应速率的原因:单位体积内活化分子数和碰撞频率。引导分析影响单位体积活化分子数的因素。 | 认识简单碰撞理论。 |
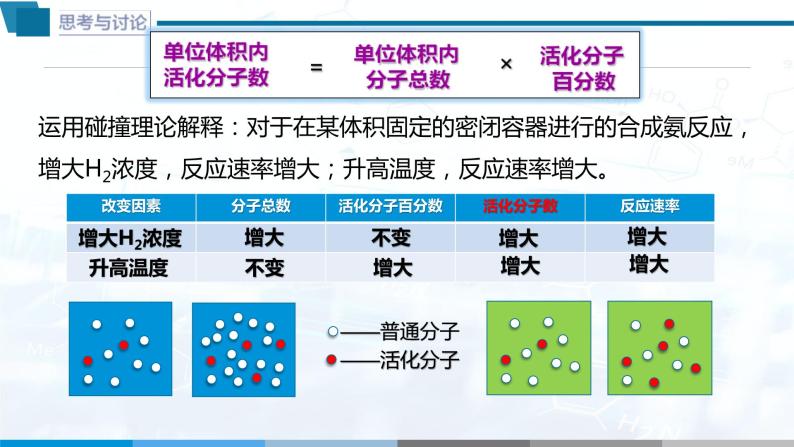
模型运用 | 结合教师引导,学生思考讨论:运用简单碰撞理论解释浓度、温度对反应速率的影响。 | 运用理论,进一步加深对 |
问题驱动:催化剂能_____,从而大幅度改变反应速率。催化剂是怎么改变活化能呢? | 回顾催化剂对反应速率 的影响 | |
结合SO2的催化氧化、CH4+CO2反应实例,反应历程图片、能量变化图。分析催化剂通过改变反应历程改变活化能,改变反应速率。 | 通过实例理解催化剂改变反 | |
模型评价 | 介绍催化剂在化学反应中的巨大作用 | 体会催化剂在生产中的价值,认识化学在生活中的价值。 |
课堂小结 | 改变单位体积活化分子个数的因素(改变百分比、分子总数)→改变反应速率 | 归纳梳理 |
九、板书设计
一、碰撞理论
1.基元反应
2.活化分子、活化能
3.碰撞理论:
4.单位体积内活化分子数=活化分子百分数×单位体积内分子总数
二、催化剂
改变反应历程,改变反应活化能,改变反应速率
十、课堂练习
1.下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
1.答案:C
2.在有气体参加的反应中,能使反应物中活化分子总数和活化分子百分数都增大的措施有( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
A.①② B.②④ C.①③ D.③④
2.答案:D
3.已知可逆反应:A(g) + B(g) C (g) △H,在某密闭体系中进行该反应,反应过程中能量变化如图所示。下列说法正确的是( )
A.为逆反应的活化能,为正反应的活化能
B.曲线Ⅱ使用了催化剂,降低了反应的反应焓变
C.,该反应为吸热反应
D.活化能越大,反应越容易进行
3.答案:A
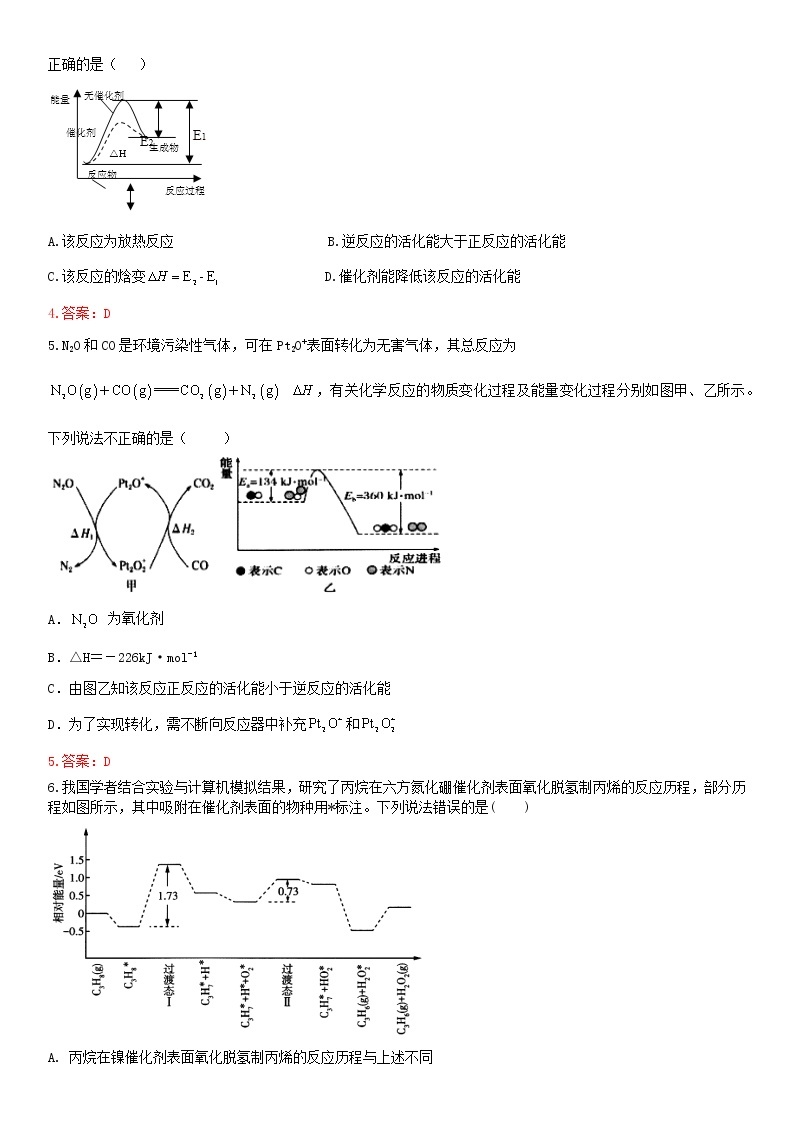
4.已知能催化分解,的反应机理及反应进程中的能量变化如下,
步骤①:
步骤②:
下列有关分解反应说法错误的是( )
A.
B.该反应的
C.增大的浓度能够加快反应速率
D.若不加,正反应的活化能比逆反应大
4.答案:D
5.已知反应:2NO(g)+Br2(g) 2NOBr (g) △H=-a kJ/mol (a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2 (g) 快
②NO(g)+ NOBr2 (g) 2NOBr (g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.是该反应的催化剂
C.正反应的活化能比逆反应的活化能小
D.增大的浓度能增大活化分子百分数,加快反应速率
5.答案:C
6.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途
径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
下列说法正确的是 ( )
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为电能
C.使用TiO2作催化剂可以降低反应的活化能,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) == 2CO(g) + O2(g) ΔH= + 30 kJ/mol
6.答案:C
7.碳单质在生产生活中用途广泛。炭黑可以活化氧分子得到活化氧,活化氧可以快速氧化,从而消除雾霾。其活化过程中的能量变化如图所示,下列说法错误的是( )
A.活性炭可去除水中的悬浮杂质
B.生成活化氧的
C.活化过程中有水时的活化能降低了
D.氧化的过程中,炭黑起催化作用
7.答案:B
人教版 (2019)选择性必修1第一节 化学反应速率一等奖ppt课件: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率一等奖ppt课件,文件包含人教版高中化学选择性必修一212《活化能》课件pptx、人教版高中化学选择性必修一212《活化能》学案docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中人教版 (2019)第一节 电离平衡课前预习课件ppt: 这是一份高中人教版 (2019)第一节 电离平衡课前预习课件ppt,文件包含选择性必修1第三章第一节第2课时电离平衡-教学课件pptx、选择性必修1第三章第一节第2课时电离平衡-教学设计docx、选择性必修1第三章第一节第2课时电离平衡-学案docx、选择性必修1第三章第一节第2课时电离平衡-作业设计docx等4份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
化学选择性必修1第二节 化学平衡教学ppt课件: 这是一份化学选择性必修1第二节 化学平衡教学ppt课件,文件包含选择性必修1第二章第二节第3课时影响化学平衡的因素-教学课件pptx、选择性必修1第二章第二节第3课时影响化学平衡的因素-学案doc、选择性必修1第二章第二节第3课时影响化学平衡的因素-教学设计1docx、选择性必修1第二章第二节第3课时影响化学平衡的因素-作业设计docx等4份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













