
鲁科版高考化学一轮总复习第5章第2节化学能转化为电能——电池课时学案
展开第2节 化学能转化为电能——电池
考试评价解读
1.能分析、解释原电池的工作原理,能设计简单的原电池。
2.能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。
3.能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如新型电池的开发等。
核心素养达成
变化观念
与
平衡思想
认识原电池的本质是氧化还原反应。能多角度、动态地分析原电池中物质的变化及能量的转换。
证据推理
与
模型认知
能利用典型的原电池装置,分析原电池原理,建立解答原电池问题的思维模型,并利用模型揭示其本质及规律。
原电池的工作原理
[以练带忆]
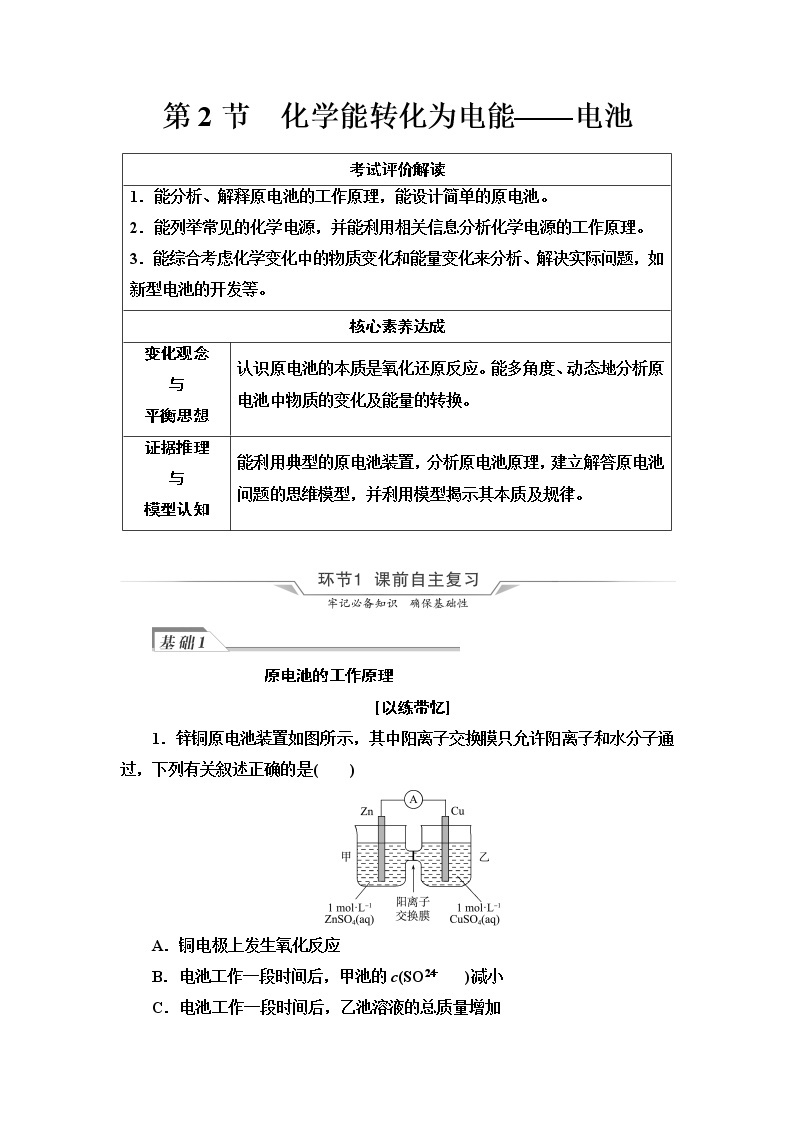
1.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO )减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
C 解析:由锌的活泼性大于铜,可知铜电极为正极,在正极上,Cu2+得电子发生还原反应生成Cu,A错误;由于阳离子交换膜只允许阳离子和水分子通过,故甲池的c(SO)不变,B错误;在乙池中Cu2++2e-===Cu,同时甲池中的Zn2+通过阳离子交换膜进入乙池中,由于M(Zn2+)>M(Cu2+),故乙池溶液的总质量增加,C正确;阳离子交换膜只允许阳离子和水分子通过,电解过程中Zn2+通过阳离子交换膜移向正极保持溶液中电荷平衡,阴离子是不能通过交换膜的,D错误。
2.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
编号
①
②
③
④
实验
装置
部分
实验
现象
a极质量减少;b极质量增加
b极有气体产生;c极无变化
d极溶解;c极有气体产生
电流从a
极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
C 解析:由实验①可知,a做原电池负极,b做原电池正极,活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d做原电池负极,c做正极,活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,活动性:d>a。综上所述,可知活动性:d>a>b>c。
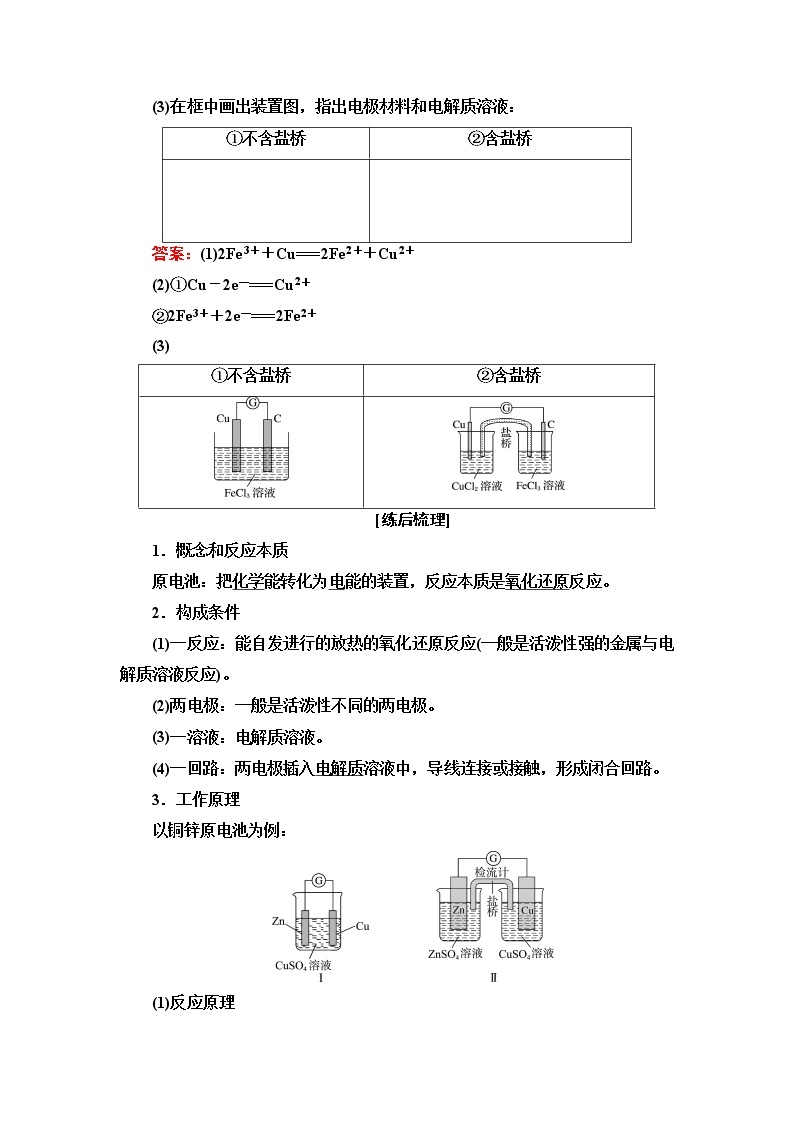
3.设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:_________。
(2)若要将上述反应设计成原电池,电极反应式分别是
①负极:____________________________________。
②正极:____________________________________。
(3)在框中画出装置图,指出电极材料和电解质溶液:
①不含盐桥
②含盐桥
答案:(1)2Fe3++Cu===2Fe2++Cu2+
(2)①Cu-2e-===Cu2+
②2Fe3++2e-===2Fe2+
(3)
①不含盐桥
②含盐桥
[练后梳理]
1.概念和反应本质
原电池:把化学能转化为电能的装置,反应本质是氧化还原反应。
2.构成条件
(1)一反应:能自发进行的放热的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)。
(2)两电极:一般是活泼性不同的两电极。
(3)一溶液:电解质溶液。
(4)一回路:两电极插入电解质溶液中,导线连接或接触,形成闭合回路。
3.工作原理
以铜锌原电池为例:
(1)反应原理
电极名称
负极
正极
电极材料
锌片
铜片
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
电子流向
由Zn片沿导线流向Cu片
盐桥中
离子移向
盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极
(2)盐桥的作用
①连接内电路,形成闭合回路。
②平衡电荷,使原电池不断产生电流。
4.原电池原理的应用
(1)比较金属的活动性强弱:原电池中,负极一般是活动性较强的金属,正极一般是活动性较弱的金属(或能导电的非金属)。
(2)加快化学反应速率:氧化还原反应形成原电池时,反应速率加快。
(3)用于金属的防护:将需要保护的金属制品做原电池的正极而受到保护。
(4)设计制作化学电源
①首先将氧化还原反应分成两个半反应。
②根据原电池的工作原理,结合两个半反应,选择正、负电极材料以及电解质溶液。
在原电池内部,阳离子向正极移动,阴离子向负极移动。
化学电源
[以练带忆]
1.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.锌锰干电池中,锌电极是负极
C.甲醇燃料电池可把化学能转化为电能
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D 解析:锂电池属于可充电电池,属于二次电池,故A正确;锌锰干电池中,锌是活泼金属,做负极,故B正确;燃料电池是把化学能转化成电能的装置,故C正确;原电池中电子从负极经外电路流向正极,锌做负极,铜做正极,电子从锌电极沿外电路流向铜电极,故D错误。
2.“天宫一号”飞行器白天靠太阳能帆板产生电流向镍氢电池充电,夜间镍氢电池向飞行器供电。镍氢电池的结构示意图如图所示。若电池总反应为2Ni(OH)22NiOOH+H2↑。则下列说法正确的是( )
A.放电时,NiOOH发生氧化反应
B.充电时,a电极的pH增大,K+移向b电极
C.充电时,a电极的电极反应为2H2O+2e-===H2↑+2OH-
D.放电时,负极反应为NiOOH+H2O+e-===Ni(OH)2+OH-
C 解析:放电时,NiOOH在正极上放电,发生还原反应生成Ni(OH)2,A错误;充电时,a电极做阴极,电极反应式为2H2O+2e-===H2↑+2OH-,pH增大,K+移向a电极,B错误,C正确;放电时,负极上H2放电,D错误。
3.普通锌锰干电池的简图如图所示。该电池工作时的总反应为Zn+2NH+2MnO2===[Zn(NH3)2]2++Mn2O3+H2O。下列关于锌锰干电池的说法中正确的是( )
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池负极反应式为2MnO2+2NH+2e-===Mn2O3+2NH3+H2O
C.原电池工作时,电子从负极通过外电路流向正极
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
C 解析:普通锌锰干电池是一次电池,不能充电复原,A项错误;根据原电池工作原理,负极失电子,B项错误;由Zn~[Zn(NH3)2]2+~2e-可知,每通过0.1 mol电子,消耗锌的质量是65 g·mol-1 ×=3.25 g,D项错误。
[练后梳理]
1.一次电池:只能使用一次,不能充电复原继续使用。
(1)碱性锌锰干电池
总反应:Zn+2MnO2+H2O===2MnOOH+ZnO。
负极材料:Zn。
电极反应:Zn+2OH--2e-===ZnO+H2O。
正极材料:碳棒。
电极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-。
(2)纽扣式银锌电池
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
电解质:KOH。
负极材料:Zn。
电极反应:Zn+2OH--2e-===Zn(OH)2。
正极材料:Ag2O。
电极反应:Ag2O+H2O+2e-===2Ag+2OH-。
(3)锂电池
LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为8Li+3SOCl2===6LiCl+Li2SO3+2S。
a.负极材料为锂,电极反应为Li-e-===Li+。
b.正极的电极反应为3SOCl2+8e-===2S+SO+6Cl-。
2.二次电池:放电后能充电复原继续使用。
(1)铅蓄电池
总反应:Pb+PbO2+2H2SO42PbSO4+2H2O
①放电时——原电池
负极反应:Pb+SO-2e-===PbSO4;
正极反应:PbO2+4H++SO+2e-===PbSO4+2H2O。
②充电时——电解池
阴极反应:PbSO4+2e-===Pb+SO;
阳极反应:PbSO4+2H2O-2e-===PbO2+4H++SO。
(2)图解二次电池的充放电
3.燃料电池
氢氧燃料电池可分为酸性和碱性两种。
种类
酸性
碱性
负极反应式
2H2-4e-===4H+
2H2+4OH--4e-===4H2O
正极反应式
O2+4H++4e-===2H2O
O2+2H2O+4e-===4OH-
电池总
反应式
2H2+O2===2H2O
备注
燃料电池的电极不参与反应,有很强的催化活性,起导电作用
二次电池的充放电规律
(1)充电时电极的连接:充电时负极接外接电源负极后做阴极,正极接外接电源正极后做阳极,简记为“正接正,负接负”。
(2)工作时的电极反应式:同一电极上的电极反应式,在充电与放电时,形式上恰好是相反的;同一电极周围的溶液,充电与放电时pH的变化趋势也恰好相反。
考点1 原电池的工作原理与应用
[抓本质·悟考法]
实验小组探究铝片做电极材料时的原电池反应,实验如下:
①
②
③
煮沸冷却后的溶液
电流计指针向右偏转,镁片、铝片表面产生无色气泡
电流计指针迅速向右偏转,逐渐向零刻度恢复,经零刻度后继续向左偏转;镁片表面开始时无明显现象,一段时间后有少量气泡逸出;铝片表面持续有气泡逸出
电流计指针向左偏转。铝片表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝片表面气泡略有减少
下列说法不正确的是( )
A.实验①中,镁片做原电池的负极
B.实验②中,初始时的实验现象对应的原电池反应为2Mg+O2+2H2O===2Mg(OH) 2
C.实验②中,一段时间后,铝片发生的电极反应式为Al-3e-===Al3+
D.实验① ~ ③可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2等因素有关
【解题关键点】 (1)根据图示和有关现象判断原电池的正负极是解题的关键;
(2)在书写电极反应式时,一定要结合溶液的酸碱性。
【易错失分点】本题在判断原电池的正负极时,要根据电流计指针偏转方向和电极上的现象,而不是根据金属的活泼性。
[自主解答]
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
C 解析:实验①中,电解质溶液为盐酸,镁和铝都可以和盐酸反应,但是金属镁更活泼为负极,故A正确;实验②中,初始时镁为负极,失电子发生氧化反应,电极反应式为Mg+2OH--2e-===Mg(OH)2↓,Al为正极,溶解的氧气在此电极得电子发生还原反应,电极反应式为O2+2H2O+4e-===4OH-,电池总反应2Mg+O2+2H2O===2Mg(OH) 2↓,故B正确;实验②中,一段时间后,铝为负极失电子发生氧化反应,电极反应式为2Al+8OH--6e-===2[Al(OH)4]-,镁为正极,氢离子在此电极得电子发生还原反应,电极反应式为6H2O+6e-===3H2↑+6OH-,故C错误;实验①~③可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2等因素有关,故D正确。
[多角度·突破练]
⊳角度1 原电池的组成及其工作原理
1.在如图所示的8个装置中,属于原电池的是( )
A.①④ B.③④⑤ C.④⑧ D.②④⑥⑦
D 解析:根据原电池的构成条件可知:①中只有一个电极,③中两电极材料相同,⑤中酒精不是电解质,⑧中两电极材料相同且无闭合回路,故①③⑤⑧不能构成原电池。
2.实验发现,298 K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )
A.该原电池的正极反应是Zn-2e-===Zn2+
B.左侧烧杯中溶液的红色逐渐褪去
C.该电池的铂电极上有气泡出现
D.该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
B 解析:该电池的总反应为Zn+2Fe3+===2Fe2++Zn2+,所以左烧杯中Pt电极为正极,电极反应为Fe3++e-===Fe2+,右烧杯中Zn电极为负极,电极反应为Zn-2e-===Zn2+。由于左烧杯中的Fe3+被还原为Fe2+,所以左烧杯中溶液的红色逐渐褪去。
判断原电池正、负极的五种方法
⊳角度2 原电池电极反应式和总反应式的书写
3.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.电池的总反应是2C4H10+13O2===8CO2+10H2O
C.通入空气的一极是正极,电极反应式为O2-4e-===2O2-
D.通入丁烷的一极是正极,电极反应式为C4H10+13O2-+26e-===4CO2+5H2O
B 解析:原电池的负极发生氧化反应,电极反应式为C4H10+13O2--26e-===4CO2+5H2O;原电池的正极发生还原反应,电极反应式为O2+4e-===2O2-,在熔融电解质中O2-由正极移向负极。
4.(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图甲所示:
甲
①HS-在硫氧化菌作用下转化为SO的反应式是_____________________。
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是________________________________________________。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图乙所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
乙
①放电过程中,Li+向________(填“负极”或“正极”)移动。
②负极反应式为_____________________________________。
③电路中每转移0.2 mol电子,理论上生成________g Pb。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图丙所示。
丙
①a电极的电极反应式是____________________________。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因:______________________________________________________。
解析:(1)①酸性环境中反应物为HS-,产物为SO,利用质量守恒和电荷守恒进行配平得:HS-+4H2O-8e-===SO+9H+;②从质量守恒角度来说,HS-、SO浓度不会发生变化,只要有两种细菌存在,就会循环把有机物氧化成CO2放出电子。(2)③根据化学方程式,电路中每转移0.2 mol电子,生成0.1 mol Pb,即20.7 g。(3)①a电极是通入NH3的电极,失去电子,发生氧化反应,所以该电极做负极,电极反应式是2NH3+6OH--6e-===N2+6H2O;②一段时间后,需向装置中补充KOH,原因是发生反应:4NH3+3O2===N2+6H2O,有水生成,使得溶液逐渐变稀,为了维持碱的浓度不变,所以要补充KOH。
答案:(1)①HS-+4H2O-8e-===SO+9H+
②HS-、SO浓度不会发生变化,只要有两种细菌存在,就会循环把有机物氧化成CO2放出电子
(2)①正极 ②Ca+2Cl--2e-===CaCl2 ③20.7
(3)①2NH3+6OH--6e-===N2+6H2O
②发生反应:4NH3+3O2===2N2+6H2O,有水生成,使得溶液逐渐变稀,为了维持碱的浓度不变,所以要补充KOH
“三步”完成原电池电极反应式的书写
⊳角度3 原电池原理的应用
5.M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。这四种金属的还原性由强到弱的顺序是( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A 解析:由①知,金属活动性:M>N;M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出,说明M是原电池的正极,故金属活动性:P>M;N、E构成的原电池中,N是负极,故金属活动性:N>E。
6.等质量的两份锌粉a、b,分别加入过量的稀硫酸中,同时向a中滴入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
D 解析:a中Zn与CuSO4溶液反应置换出Cu,Zn的量减少,产生H2的量减少,但Zn、Cu和稀硫酸形成原电池,加快反应速率,D项符合要求。
本题中若把“过量的稀硫酸”改为“等浓度等体积的少量稀硫酸”,则正确的是哪个图像?
应注意Zn与稀硫酸反应置换出Cu,Cu、Zn在稀硫酸中形成原电池,可加快反应速率,但由于两份锌粉均过量,因此产生H2的体积相同,则应选A。
考点2 形形色色的燃料电池
[抓本质·悟考法]
如图为以葡萄糖为燃料的微生物燃料电池的结构示意图。下列关于该电池的叙述不正确的是( )
A.该电池不能在高温下工作
B.电池的负极反应为C6H12O6+24OH--24e-===6CO2↑+18H2O
C.放电过程中,电子从正极区向负极区每转移1 mol,便有1 mol H+从阳极室进入阴极室
D.微生物燃料电池具有高能量转换效率、原料广泛、操作条件温和、有生物相容性等优点,值得研究与推广
【解题关键点】 (1)装置为以葡萄糖为燃料的微生物燃料电池,属于原电池。
(2)装置图中显示了电子移动的方向。
(3)装置图中注明了阴极、阳极和阴极区、阳极区。
(4)装置中显示了阳极产生CO2,阴极吸收O2。
(5)装置中使用了质子交换膜,显示了H+移动的方向。
【易错失分点】 (1)易从图中显示的阴极、阳极和阴极区、阳极区,把图中装置当成了电解池,导致解答错误。
(2)不能从溶液中H+的移动,理解书写两极反应时,可以生成H+或H+参与反应。
(3)不会判断有机反应中电子转移数目。
[自主解答]
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
_______________________________________________________________
BC 解析:高温条件下微生物会死亡,电池不能正常工作,A选项正确;电池的负极失电子,发生氧化反应,即葡萄糖失电子生成CO2气体,从题图中可以看出反应生成H+,电极反应为C6H12O6+6H2O-24e-===6CO2↑+24H+,B选项错误;放电过程中,电子从负极区向正极区转移,C选项错误;结合题给条件分析,D选项正确。
[多角度·突破练]
⊳角度1 电解质水溶液燃料电池
1.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH--14e-===2CO+12H2O。有关此电池的推断不正确的是( )
A.通入氧气的电极为正极
B.参加反应的O2与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度将下降
D.放电一段时间后,正极区附近溶液的pH减小
D 解析:A项,通入乙烷的一极为负极,通入氧气的一极为正极,正确;B项,1 mol乙烷参与反应时转移14 mol电子,则参与反应的氧气的量为= mol,正确;C项,根据电极反应式或总反应方程式可知,氢氧化钾被消耗,正确;D项,放电时正极反应2H2O+O2+4e-===4OH-,正极产生OH-,则pH增大,错误。
2.关于如图微生物燃料电池结构示意图的说法:①微生物促进了电子的转移 ②微生物所在电极区放电时发生还原反应 ③放电过程中,H+从正极区移向负极区 ④正极反应式为MnO2+4H++2e-===Mn2++2H2O,正确的是( )
A.②④ B.①③ C.①④ D.②③
C 解析:①在微生物作用下Cm(H2O)n转化为CO2促进电子的转移,正确;②微生物在右侧,右侧电极为电源的负极,所以微生物所在电极区放电时发生氧化反应,错误;③根据电流的方向,放电过程中,H+从负极区移向正极区,错误;④电池左侧为电池的正极区,MnO2在H+条件下发生得电子的还原反应,所以正极反应式为MnO2+4H++2e-===Mn2++2H2O,正确。
3.(2021·郑州模拟)微生物燃料电池(MFC)利用了一种现代化氨氮去除技术。如图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是( )
A.好氧微生物反应器中的反应为NH+2O2=== NO+2H++H2O
B.B极电势比A极电势低
C.A极的电极反应式为CH3COO-+2H2O+8e-===2CO2↑+7H+
D.当电路中通过9 mol电子时,理论上总共生成标准状况下33.6 L N2
A 解析:NH在好氧微生物反应器中转化为NO,结合得失电子守恒、电荷守恒及原子守恒得到反应的离子方程式为NH+2O2===NO+2H++H2O,故A正确;根据H+的移动方向可知,A做原电池的负极,B做原电池的正极,所以B极电势比A极电势高,故B错误;A极做负极,负极上CH3COO-发生失电子的氧化反应生成CO2气体,则A极的电极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,故C错误;NO在正极得到电子生成氮气,电极反应式为2NO+12H++10e-===N2↑+6H2O,电路中通过9 mol电子时,理论上总共生成0.9 mol N2,其在标准状况下的体积为20.16 L,故D错误。
燃料电池的分析要领
(1)对于燃料电池要注意介质是电解质溶液还是熔融盐或氧化物。
(2)通入负极的物质为燃料(还原剂),通入正极的物质为氧气(氧化剂)。
(3)通过介质中离子的移动方向,可判断电池的正负极,同时考虑该离子参与靠近一极的电极反应。
⊳角度2 固体电解质燃料电池
4.某种熔融碳酸盐燃料电池以 Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法正确的是( )
A.a为CH4,b为CO2
B.CO向正极移动
C.此电池在常温下也能工作
D.正极的电极反应式为O2+2CO2+4e-===2CO
D 解析:电极反应式如下:
负极:CH4+4CO-8e-===5CO2+2H2O
正极:2O2+4CO2+8e-===4CO
根据图示中电子的移向,可以判断a处通入甲烷,b处通入空气,CO应移向负极,由于电解质是熔融盐,此电池在常温下不能工作。
5.氢氧熔融碳酸盐燃料电池是一种高温电池(工作温度600~700 ℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是( )
A.电池工作时,熔融碳酸盐只起到导电的作用
B.负极反应式为H2-2e-+CO===CO2+H2O
C.该电池可利用工厂中排出的CO2,减少温室气体的排放
D.电池工作时,外电路中流过0.2 mol电子,消耗 3.2 g O2
B 解析:根据图示,在氢氧熔融碳酸盐燃料电池中,通入氢气的电极为负极,负极发生氧化反应,电极反应式为H2+CO-2e-===CO2+H2O,通入氧气的电极为正极,正极发生还原反应,电极反应式为O2+2CO2+4e-===2CO,总反应为2H2+O2===2H2O,故B项正确;电池工作时,熔融碳酸盐参与了电极反应,A项错误;该电池工作时利用的是二氧化碳的循环使用,没有消耗二氧化碳,不能减少温室气体的排放,C项错误;电池工作时,外电路中流过0.2 mol电子,消耗0.05 mol氧气,质量为1.6 g,D项错误。
6.世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-===Fe+xO2-
C.铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2
D.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
C 解析:a极空气中氧气得电子发生还原反应,为正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应,为负极。在原电池中,阴离子向负极移动,O2-由a极移向b极,A项错误;a极空气中氧气得电子发生还原反应为正极,电极反应式为O2+4e-===2O2-,B项错误;由新型中温全瓷铁空气电池的装置图可知,铁表面发生的反应为xH2O(g)+Fe===FeOx+xH2,C项正确;有 22.4 L(标准状况)空气参与反应,则氧气约为0.2 mol,电路中约转移0.8 mol电子,D项错误。
燃料电池电极反应式的书写
在书写燃料电池电极反应和总反应时,应注意两个方面:一是要注意是否在溶液中进行,如果在溶液中进行,要根据溶液的酸碱性书写;二是理解氧化还原反应规律,正确区分得失电子的物质,据此找到在正、负极上分别反应的物质,然后根据原电池原理正确书写电极反应式和总反应式。
如甲烷燃料电池(电解质溶液:NaOH溶液)的反应式为
CH4+2O2===CO2+2H2O ①
CO2+2NaOH===Na2CO3+H2O ②
①式+②式得燃料电池总反应式为CH4+2O2+2NaOH===Na2CO3+3H2O。
书写电极反应式的方法:
(1)正极反应式:根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,电解质溶液不同,其电极反应有所不同。
熟记以下四种情况:
①酸性电解质溶液环境下电极反应式:
O2+4H++4e-===2H2O。
②碱性电解质溶液环境下电极反应式:
O2+2H2O+4e-===4OH-。
③固体电解质(高温下能传导O2-)环境下电极反应式:O2+4e-===2O2-。
④熔融碳酸盐(如熔融K2CO3)环境下电极反应式:O2+2CO2+4e-===2CO。
(2)负极反应式:负极上CH4在溶液中失去电子与OH-结合最终得到CO和H2O。可以先写出反应进行配平:H4+OH--8e-——O+H2O
反应中C化合价升高8,故反应中失去8e-。然后根据电荷守恒,可以把反应方程式配平,须注意反应中失去8e-,相当于反应物中增加了8个正电荷。配平后反应为CH4+10OH--8e-===CO+7H2O。
1.一定条件下,实验室利用如图所示装置,通过测电压求算Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法正确的是( )
A.右池中的银电极做负极
B.正极反应为Ag-e-===Ag+
C.总反应为Ag++Cl-===AgCl↓
D.盐桥中的NO向右池方向移动
C 解析:若“右池中的银电极做负极”,Ag失去电子被氧化为Ag+:Ag-e-===Ag+,电极质量减轻,不符合题干中的信息“两电极质量均增大”,A项错误。该装置图很容易让考生联想到盐桥电池,抓住“两电极质量均增大”判断,若左池Ag失去电子被氧化为Ag+,Ag+再结合溶液中的Cl-生成AgCl:Ag-e-+Cl-===AgCl,即左池的银失去电子做负极;此时右池电解质溶液中的Ag+在银电极表面得到电子被还原为Ag:Ag++e-===Ag,即右池的银电极为正极;两个电极反应式相加得到总反应:Ag++Cl-===AgCl↓;综上所述,B项错误,C项正确。盐桥中的NO向负极方向(即左池)移动,D项错误。
2.(命题情境:化学平衡移动与原电池)控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流表读数为零时,反应达到化学平衡状态
D.电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
D 解析:由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确;电流表读数为零时,Fe3+得电子速率等于Fe2+失电子速率,反应达到平衡状态,C正确;D项在甲中溶入FeCl2固体,平衡2Fe3++2I-2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
3.(命题情境:原电池应用于废水处理问题)下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( )
A.a、b极不能使用同种电极材料
B.工作时,a极的电势低于b极的电势
C.工作一段时间之后,a极区溶液的pH增大
D.b极的电极反应式为CH3COO-+4H2O-8e-===2HCO+9H+
D 解析:题图中连接负载(用电器)的装置为原电池,电极a、b上发生的反应不同,因而两极间形成电势差,故电极材料可同可异,A项错误;工作时,电极b上CH3COO-→HCO,碳元素从平均0价失电子升至+4 价,电极b是原电池的负极,则电极a是原电池的正极,a极的电势高于b极的电势,B项错误;电极a(正极)的电极反应为+H ++2e-===+Cl-,正极每得到2 mol电子时,为使溶液呈电中性,必有2 mol H+通过质子交换膜进入a极溶液,同时电极反应消耗 1 mol H+,故工作一段时间之后,a极区溶液中H+浓度增大,pH减小,C项错误;据题图中物质转化,考虑到质量守恒和电荷守恒关系,电极b(负极)的电极反应为CH3COO-+4H2O-8e-===2HCO+9H+,D项正确。
4.(命题情境:原电池与航天科技)近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化、航天器的零排放方面做出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化,总反应方程式为2CO2===2CO+O2。关于该装置下列说法正确的是( )
A.装置中离子交换膜为阳离子交换膜
B.CO2参与X电极的反应方程式:CO2+H2O+2e-===CO+2OH-
C.N型半导体为正极,P型半导体为负极
D.反应完毕,电解质溶液碱性减弱
B 解析:左半部分为原电池,右半部分为电解池。根据原电池中电荷的移动方向可知,N型半导体为负极,P型半导体为正极,C项错误;则X电极为阴极,发生还原反应:CO2+H2O+2e-===CO+2OH-,B项正确;图中OH-在X电极处产生,Y电极需消耗OH-,说明OH-能够通过离子交换膜,即该膜为阴离子交换膜,A项错误;根据总反应2CO2===2CO+O2可知,反应前后电解质溶液酸碱性不变,D项错误。
5.(双选)Zulema Borjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
A.该装置不能在高温下工作
B.X、Y依次为阳离子、阴离子交换膜
C.负极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+
D.该装置工作时,电能转化为化学能
AC 解析:高温能使微生物蛋白质凝固变性,导致电池工作失效,所以该装置不能在高温下工作,A正确;原电池内电路中:阳离子移向正极、阴离子移向负极,从而达到脱盐目的,所以Y为阳离子交换膜、X为阴离子交换膜,B错误;由题图可知,负极为有机废水中CH3COO-失电子发生氧化反应,电极反应为CH3COO-+2H2O-8e-===2CO2↑+7H+,C正确;该装置工作时为原电池,是将化学能转化为电能的装置,D错误。
鲁科版高考化学一轮复习第6章第32讲化学能转化为电能——电池教学课时学案: 这是一份鲁科版高考化学一轮复习第6章第32讲化学能转化为电能——电池教学课时学案,共25页。
鲁科版高考化学一轮总复习第8章第1节第2课时烃课时学案: 这是一份鲁科版高考化学一轮总复习第8章第1节第2课时烃课时学案,共17页。
鲁科版高考化学一轮总复习第3章第3节氮的循环课时学案: 这是一份鲁科版高考化学一轮总复习第3章第3节氮的循环课时学案,共23页。












