2022中考化学实验探究题:酸的性质探究(拔高型)(无答案)
展开2022中考化学实验探究题:
酸的性质探究(拔高型)
(考频:★★★★★)
1. 化学课上同学们进行实验验证酸的性质。
(1) I. 与指示剂作用。
在白色点滴板孔穴1、3中加入紫色石蕊溶液,观察到溶液变________色。
(2) 将无色酚酞溶液滴加到孔穴2、4中,观察到孔穴4中溶液为无色,而孔穴2中溶液变为橙色。同学们猜想孔穴2中的异常现象与硫酸溶液的浓度过高有关,并通过以下实验证明该猜想正确:取少量上述橙色溶液于试管中,加水稀释,观察到的现象是_______。
(3) II. 与铁锈反应。
实验 | 实验试剂 | 实验现象 |
1 | 锈蚀铁钉+10 mL稀盐酸 | 生成无色气泡,铁锈较快消失,溶液颜色变黄。 |
2 | 锈蚀铁钉+10mL稀硫酸 | 生成无色气泡,铁锈减少速度缓慢,溶液颜色未变黄。 |
(提出问题)
实验1、2现象不同的原因是什么?
(查阅资料)
HCl在水中会解离出H+和Cl-,H2SO4在水中会解离出H+和SO42-。
(假设猜想)
可能和溶液中阴离子不同有关。
(进行实验)
实验 | 实验试剂 | 实验现象 |
3 | 锈蚀铁钉+10mL稀硫酸+_A_ | 生成无色气泡,铁锈减少速度比实验2快,溶液颜色变黄。 |
4 | 锈蚀铁钉+10mL稀盐酸+Na2SO4 | 生成无色气泡,铁锈减少速度比实验1慢,溶液颜色变黄。 |
(解释和结论)
铁锈(主要成分为Fe2O3)和盐酸反应的化学方程式是________。
(4) 实验1中产生的无色气体是________。
(5) 实验3中,物质A是________。
(6) 结合实验1~4,得出的结论是________。
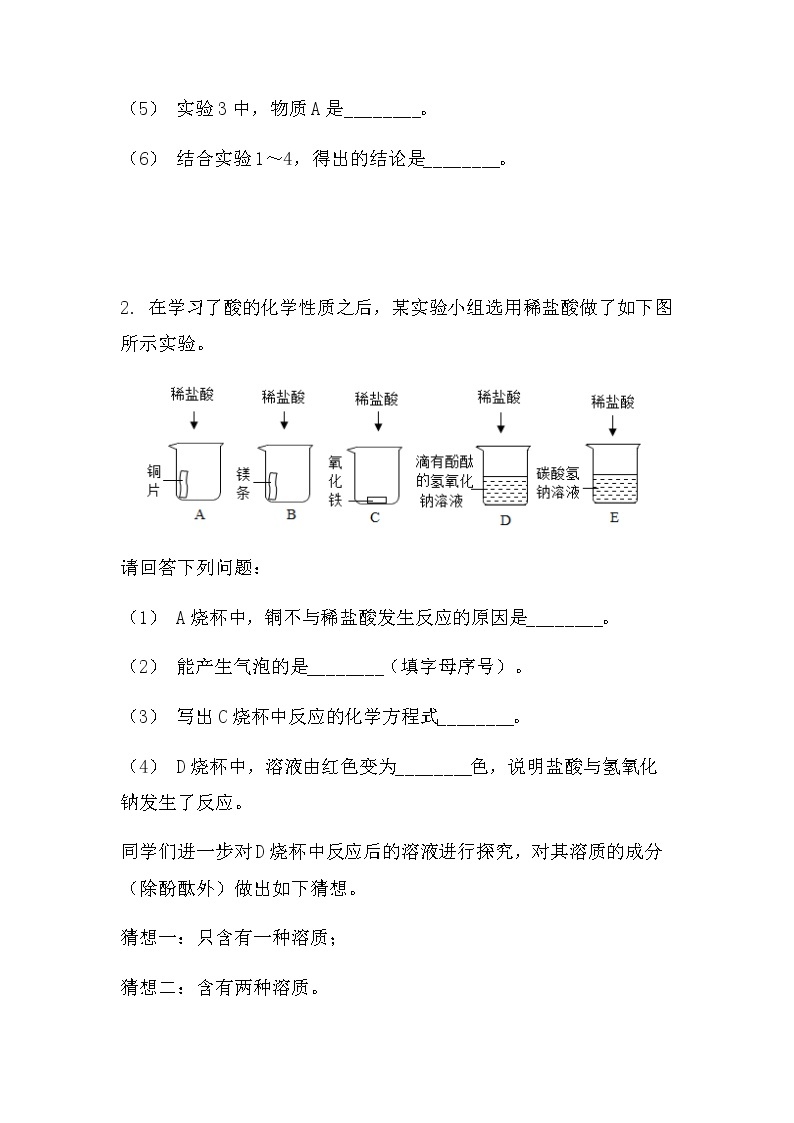
2. 在学习了酸的化学性质之后,某实验小组选用稀盐酸做了如下图所示实验。
请回答下列问题:
(1) A烧杯中,铜不与稀盐酸发生反应的原因是________。
(2) 能产生气泡的是________(填字母序号)。
(3) 写出C烧杯中反应的化学方程式________。
(4) D烧杯中,溶液由红色变为________色,说明盐酸与氢氧化钠发生了反应。
同学们进一步对D烧杯中反应后的溶液进行探究,对其溶质的成分(除酚酞外)做出如下猜想。
猜想一:只含有一种溶质;
猜想二:含有两种溶质。
为了验证上述猜想,进行如下实验,请完成下列表格。
实验操作 | 测定结果 | 得出结论 |
用玻璃棒蘸取D烧杯中反应后的溶液,滴在pH试纸上,与标准比色卡比较 | pH<7 | 猜想________正确,溶液中的溶质是________。 |
小组同学选用稀硫酸代替稀盐酸重复实验,证明了硫酸与盐酸具有相似的化学性质。酸有一些相似的化学性质,是因为在不同的酸溶液中都含有相同的________。
3. 硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
(1) Ⅰ、挥发性
(实验1)
取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到________,原因是________。
(2) Ⅱ、不稳定性
(查阅资料1)
硝酸是无色液体,见光或受热分解生成红棕色的NO2气体、氧气及一种无色液体 硝酸分解的化学方程式为:________。
(3) (实验2)
取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号 | ① | ② | ③ |
实验条件 | |||
实验现象 | 6分钟出现浅红棕色15分钟红棕色比较明显30分钟红棕色非常明显 | 60分钟无明显变化 | 3分钟出现浅红棕色6分钟红棕色比较明显10分钟红棕色非常明显 |
实验①、②对比是研究________对浓硝酸稳定性的影响。
实验①、③对比可得出的结论是________。
(4) Ⅲ、酸性
(查阅资料2)
硝酸能够与金属氧化物反应生成盐和水。
(实验3)
向氧化铜粉末中加入硝酸,能够看到的现象是________。
IV、氧化性
(查阅资料3)
浓硝酸在加热条件下能与木炭发生反应:
C+4HNO3(浓)加热 4NO2↑+CO2↑+2H2O。
(实验4)
如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能是________。
4. 盐酸、硫酸和硝酸都是重要的酸,下列是探究酸性质的实验。
(1) 能区分稀盐酸和稀硫酸的是________(选填“实验一”“实验二”),此实验中观察到的现象是________;
(2) 若实验二中稀硫酸和硝酸钡溶液恰好完全反应,反应的化学方程式为________;如图是装有稀硫酸的试管中加入硝酸钡溶液前后主要离子种类及个数比变化示意图,则“·”代表的离子是________(填离子符号);
(3) 实验三稀盐酸中无明显现象;稀硝酸中的现象为铜片逐渐溶解,溶液变蓝,并有气泡产生,反应为3Cu+8HNO3=3Cu(NO3)2+2X↑+4H2O,则X的化学式为________;
(4) 实验室利用氢气还原氧化铜后,试管内壁上常附着一些铜,清洗方法是________。
5. 对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
A试管内________,B试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 | |
________(填“浓”或“稀”)盐酸瓶口的蓝色石蕊试纸很快变红。 | 即使是同种酸,由于________不同,它们的性质不完全相同。 | |
两试管中均产生________ | 不同的酸具有相似的性质,这是因为酸的组成中都含有________(填元素符号). | |
E试管中产生________,F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的反应的化学方程式为________。
Ⅱ.废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有________(填化学式)。
2022中考化学实验探究题:性质因素探究(拔高型)(无答案): 这是一份2022中考化学实验探究题:性质因素探究(拔高型)(无答案),共12页。试卷主要包含了 实验探究一, 用科学方法去探究等内容,欢迎下载使用。
2022中考化学实验探究题:物质制备类(拔高型)(无答案): 这是一份2022中考化学实验探究题:物质制备类(拔高型)(无答案),共12页。试卷主要包含了 化学是一门以实验为基础的科学等内容,欢迎下载使用。
2022中考化学实验探究题:物质成分探究(拔高型)(无答案): 这是一份2022中考化学实验探究题:物质成分探究(拔高型)(无答案),共13页。