





2023版高考化学一轮总复习第八章第一节化学反应速率课件
展开生成浓度为 0.5 ml·L-1。(
[自主测评]1.易错易混辨析(正确的画“√”,错误的画“×”)。(1)化学反应速率为 0.5 ml·L-1·s-1是指1 s内某物质消耗或
(2)对于任何化学反应来说,反应速率越快,反应现象就越
(3)化学反应速率是指一定时间内任何一种反应物浓度的
减少或任何一种生成物浓度的增加。(
(4)升高温度时,不论正反应是吸热还是放热,正、逆反应
(5)增大反应体系的压强,反应速率一定增大。(
(6)催化剂都不参加化学反应。(
(7)加热使反应速率增大的原因之一是活化分子百分数增
(2)×(3)×(4)√(5)×
错因:反应现象与化学反应速率快慢无关。错因:不能用固体或纯液体表示化学反应速率。错因:增大压强,物质的浓度不一定增大,反应速
错因:催化剂的催化作用是通过自身参与化学反应
(6)×实现的。(7)√
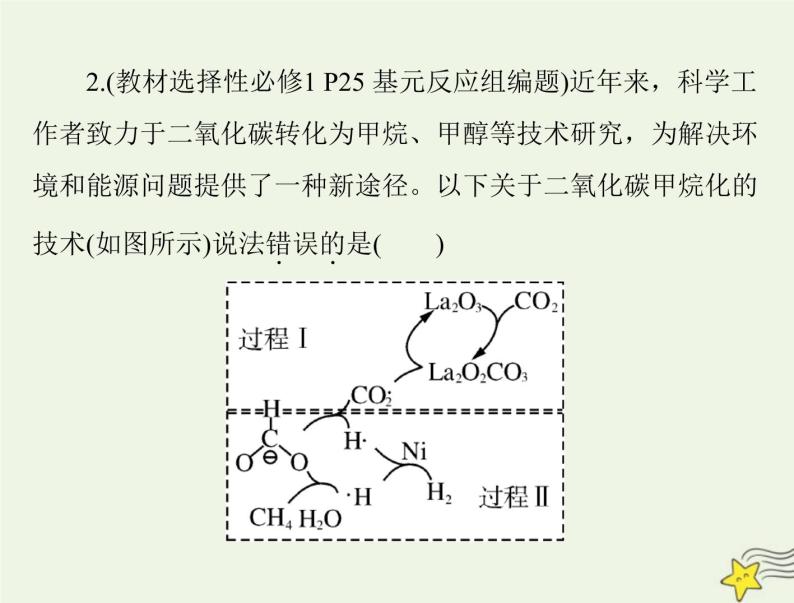
技术(如图所示)说法错误的是(
2.(教材选择性必修1 P25 基元反应组编题)近年来,科学工作者致力于二氧化碳转化为甲烷、甲醇等技术研究,为解决环境和能源问题提供了一种新途径。以下关于二氧化碳甲烷化的
A.过程Ⅰ中,CO2 分子内的化学键没有断裂B.过程Ⅰ中,La 元素的化合价没有改变C.过程Ⅱ中,H2→2H·为吸热过程
D.该技术的总反应为 4H2+CO2答案:A
1.化学反应速率的表示方法
反应体系的体积一定时,通常用单位时间内反应物浓度的________或反应产物浓度的________表示。
2.化学反应速率的数学表达式及单位
ml·L-1·min-1
3.化学反应速率与化学计量数的关系
(1)化学反应速率一般指平均速率而不是某一时刻的瞬间速率,且无论用反应物还是用生成物表示均取正值。(2)同一化学反应,相同条件下用不同物质表示反应速率,
其数值可能不同,但表示的意义可能相同。
(3)不能用固体或纯液体物质表示化学反应速率,因为固体
或纯液体物质的浓度视为常数。
【练1】(2021 年宁波十校模拟)某温度下,在容积为 2 L 的
密闭容器中投入一定量的A、B发生反应 3A(g)+bB(g)
ΔH=-Q kJ·ml-1(Q>0),12 s 时反应达到平衡,生成 C 的物质的量为 0.8 ml,反应过程中 A、B 的物质的量浓度随时间的
变化关系如图所示。下列说法正确的是(
A.前 12 s 内,A 的平均反应速率为 0.025 ml·L-1·s-1B.12 s 后,A 的消耗速率等于 B 的生成速率C.化学计量数之比 b∶c=1∶2D.12 s 内,A 和 B 反应放出的热量小于 0.4Q kJ解析:分析图像可知,12 s 内 A 的浓度变化为(0.8-0.2)
平衡状态,A 的消耗速率不等于 B 的生成速率,B 错误,C 正确;消耗 3 ml A 放热 Q kJ,12 s 内消耗 A 的物质的量为 0.6 ml·
×2 L=1.2 ml,消耗1.2 ml A放出的热量为0.4Q kJ,D错
解析:计算各物质的浓度变化量,利用浓度变化量之比等于化学计量数之比,据此确定各物质的化学计量数,再利用原子守恒用X、Y表示Z的组成,据此书写方程式。t min后,Δc(X2)=1 ml·L-1-0.4 ml·L-1=0.6 ml·L-1,Δc(Y2)=1 ml·L-1-0.8 ml·L-1=0.2 ml·L-1,Δc(Z)=0.4 ml·L-1,则X2、Y2、Z的化学计量数之比为0.6 ml·L-1∶0.2 ml·L-1 ∶0.4 ml·L-1=3∶1∶2,故反应为3X2+Y2===2Z,根据原子守恒可知,Z为X3Y,故反应可以表示为3X2+Y2===2X3Y。
[归纳提升] “三段式”法计算化学反应速率(1)基本步骤①准确写出化学方程式。②找出各物质的初始量、转化量、平衡量(物质的量浓度或物质的量)。③根据已知条件建立等式关系进行解答。(2)基本模式mA + nB===pC+qD
起始浓度/(ml·L-1)
转化浓度/(ml·L-1)
t min 末浓度/(ml·L-1) a-mx b-nx px qx
化学反应速率的大小比较
【练3】(2021 年乾安第七中学月考)在 2A+B===3C+4D
反应中,表示该反应速率最快的数据是(
解析:反应速率之比等于化学计量数之比,在速率单位相同时,化学反应速率与化学计量数的比值越大,反应速率越快,
应速率大小顺序是 B>C>A=D,反应速率最快的是 B。答案:B
A.vA=0.5 ml·L-1·s-1 B.vB=0.3 ml·L-1·s-1 C.vC=0.8 ml·L-1·s-1 D.vD=1.0 ml·L-1·s-1
【练4】(2021年青岛月考)在恒温、恒容的密闭容器中进MnO2
降到 1.0 ml·L
需 10 s,那么 H2O2 浓度由 1.0 ml·L
降到 0.5 ml·L-1 所需的反应时间为(A.5 sB.大于 5 sC.小于 5 sD.无法判断
行反应 2H2O2===== 2H2O+O2↑。若 H2O2 溶液的浓度由 2.0
解析:H2O2的浓度由2.0 ml·L-1降到1.0 ml·L-1时的平均反应速率为(2.0 ml·L-1-1.0 ml·L-1)÷10 s=0.1 ml·L-1·s-1,如速率不变,则H2O2浓度由1.0 ml·L-1降到0.5 ml·L-1所需的反应时间为(1.0 ml·L-1-0.5 ml·L-1)÷0.1 ml·L-1·s-1=5 s,但随着反应的进行,H2O浓度逐渐的减小,反应速率逐渐减小,则需要时间大于5 s。 答案:B
化学反应速率的比较方法
由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应进行的快慢不能只看数值的大小,而要进行一定的转化。(1)看单位是否统一,若不统一,换算成相同的单位。(2)换算成用同一物质表示的反应速率,再比较数值的大小。(3)比较化学反应速率与化学计量数的比值,即对于一般反
表示的反应速率比用 B 表示的反应速率大。
影响化学反应速率的因素
1.影响化学反应速率的内因化学反应速率首先是由反应物的组成、结构和性质等因素决定的。
2.影响化学反应速率的外因
3.理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞①活化分子:能够发生有效碰撞的分子。
图中:E1 为_________________,使用催化剂时的活化能为_____,反应热为________。(注:E2 为逆反应的活化能)
③有效碰撞:________分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
分子总数
(1)由于固体和纯液体的浓度可视为常数,故改变其用量反应速率不变。但当固体颗粒变小时,其表面积增大将导致反应速率增大。
(2)压强对化学反应速率的影响是通过改变反应物浓度实现的,所以分析压强的改变对反应速率的影响时,要从反应物浓度是否发生改变的角度分析。若改变总压强而各物质的浓度不改变,则反应速率不变。
(3)改变温度、使用催化剂,反应速率一定发生变化,其他
外界因素改变,反应速率则不一定发生变化。
(4)其他条件一定时,升高温度,无论正反应还是逆反应,无论放热反应还是吸热反应,反应速率都增大,只是正、逆反应速率增大的程度不同。
外界条件对化学反应速率的影响
【练1】(2021年宜昌模拟)把镁条投入盛有盐酸的敞口容器里,产生 H2 的速率可由下图表示。
在下列因素中,影响反应速率的因素是(
①盐酸的浓度③溶液的温度A.①④C.①②③
②镁条的表面积④Cl-的浓度B.③④D.②③④
解析:镁条和盐酸反应产生 H2 的离子方程式为 Mg+2H+===Mg2++H2↑,是镁与 H+间的置换反应,与 Cl-无关。在镁
条的表面有一层氧化膜,当将镁条投入盐酸中时,随着氧化膜的不断溶解,镁与盐酸接触面积不断增大,产生 H2 的速率会增大;溶液的温度对反应速率也有影响,反应放出热量,使温度
升高,反应速率也会增大;随着反应的进行,c(H+)不断减小,
【练2】(2021年蓟州擂鼓台中学月考)反应 C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的
)A.增加 H2O(g)的物质的量B.将容器的体积缩小一半C.保持体积不变,充入 N2 使体系压强增大D.保持压强不变,充入 N2 使容器体积变大
解析:对于反应 C(s)+H2O(g)
CO(g)+H2(g),有气体
参加和生成,则温度、压强都能对化学反应速率产生影响。保持体积不变,增加 H2O(g)的物质的量,气体浓度增大,反应速率增大,A 错误;将容器的体积缩小一半,相当于压强增大,单位体积内气体浓度增大,则反应速率增大,B 错误;保持体积不变,充入 N2 使体系压强增大,但反应气体的浓度不变,则反应速率不变,C 正确;保持压强不变,充入 N2 使容器体积变大,反应气体的浓度减小,反应速率减小,D 错误。答案:C
(1)压强对反应速率的影响是通过改变气体的浓度来实现的,故一般意义上的增大压强是指压缩气体的体积,减小压强是指扩大气体的体积。(2)压强对反应速率的影响情况:压强只对有气体参与的化学反应速率有影响。①恒温时:
②恒温时,对于恒容密闭容器:
气体反应物浓度增大( 压强也增
总压强增大―→反应物浓度未
b. 充入“ 惰性” 气体改变―→反应速率不变。③恒温恒压时:
充入“惰性”气体反应速率减小。
能量。下列说法不正确的是(
催化剂与反应机理、活化能
【练3】(2021 年荆州质检)如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中 E 表示分子平均能量,Ec 是活化分子具有的最低
A.图中 Ec 与 E 之差表示活化能
B.升高温度,图中阴影部分面积会增大C.使用合适的催化剂,E 不变,Ec 变小
D.能量大于 Ec 的分子间发生的碰撞一定是有效碰撞
解析:E 表示分子的平均能量,Ec 是活化分子具有的最低能量,能量等于或高于 Ec 的分子可能产生有效碰撞,活化分子具有的最低能量 Ec 与分子的平均能量 E 之差叫活化能,A 正确;当温度升高时,使活化分子百分数增大,阴影部分面积会增大,B 正确;催化剂使活化能降低,加快反应速率,使用合适的催化剂,E 不变,Ec 变小,C 正确;E 表示分子的平均能量,Ec是活化分子具有的最低能量,能量等于或高于 Ec 的分子可能产生有效碰撞,D 错误。
化如图所示。下列说法不正确的是(
【练4】(2021年湛江一模)甲硫醇是一种重要的化工试剂。在一定温度下,硫化氢与甲醇合成甲硫醇的催化过程及能量变
A.合成甲硫醇的反应为放热反应B.步骤②中,形成了 C—S 键
C.步骤①决定了合成甲硫醇反应速率的快慢
D.该催化剂可有效提高反应速率和甲醇的平衡转化率解析:由能量变化图示可知生成物总能量低于反应物总能量,反应放热,A 正确;从硫化氢与甲醇合成甲硫醇的催化过程可看出步骤②形成了 C—S 键,B 正确;由能量变化图示可知步骤①需要的反应活化能最高,决定了合成甲硫醇反应速率的快慢,C 正确;催化剂只能改变反应速率,不能改变平衡和平衡转化率,D 错误。
[归纳提升] 催化剂的特点及其对化学反应速率的影响(1)催化剂对化学反应速率的影响
催化剂在化学反应过程中参与了反应,降低了反应所需的活化能,可逆反应中同等程度改变正、逆反应速率,但不会改变反应的限度和反应热。
化学反应速率图像及其应用
【练5】(2021 年潮州模拟)温度为 T 时,向 2.0 L 恒容密闭
时改变一种条件,整个过程中 PCl5、PCl3、Cl2 的物质的量随时间的变化如图所示。
容器中充入1.0 ml PCl5,发生反应:PCl5(g) PCl3(g)+Cl2(g) ΔH=a kJ·ml-1(a>0)。0~10 min保持容器温度不变,10 min
A.0~4 min 的平均速率 v(PCl3)=0.025 ml·L-1·min-1B.10 min 时改变的条件是增加了一定量的 PCl5C.若起始时向该容器中充入 2.0 ml PCl3 和 2.0 ml Cl2,保持温度为 T,反应达平衡时放出的热量小于 1.6a kJD.温度为 T,起始时向该容器中充入 1.0 ml PCl5、0.10 mlPCl3 和 0.10 ml Cl2,反应达到平衡前 v正<v逆
解析:0 ~4 min 的平均速率 v(PCl3) =
0.2 ml2 L×4 min
的物质的量增大,平衡正向移动,则10 min 时改变的条件是升温,B 错误;从图中读出起始时向容器中充入1.0 ml PCl3 和1.0ml Cl2,保持温度为T,转化率为1-20%=80%,若起始时向该容器中充入 2.0 ml PCl3 和 2.0 ml Cl2,保持温度为 T,相当
ml·L-1·min-1,A正确;由题图可知,改变条件使PCl3(g)、Cl2(g)
于加压,故转化率大于80%,反应达平衡时放出的热量大于1.6akJ,C 错误;起始时向该容器中充入1.0 ml PCl5、0.10 ml PCl3
和 0.10 ml Cl2 , Qc =
0.05×0.050.5
= 0.005 , 结合图可知K =
>Qc,反应正向进行,v正>v逆,D 错误。
【练6】(2021 年沈阳法库高级中学月考)化合物 Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应 4~8 min 间的平均反应速率和推测反
应 16 min 时反应物的浓度,结果应是(
A.2.5 μml·L-1·min-1和2.0 μml·L-1B.2.5 μml·L-1·min-1和2.5 μml·L-1C.3.0 μml·L-1·min-1和3.0 μml·L-1D.5.0 μml·L-1·min-1和3.0 μml·L-1
间,反应物浓度变化为(20-10)μml·L-1=10 μml·L-1,可知,每隔 4 分钟,浓度变化量降为原来的一半,所以 8~12 min 浓度变化为5 μml·L-1,12~16 min浓度变化为2.5 μml·L-1,所以16 min 时浓度为10 μml·L-1 -5 μml·L-1 -2.5 μml·L-1=2.5 μml·L-1,B 正确。
[归纳提升] 有关化学反应速率的图像分析方法
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物,一般生成物多数以原点为起点。(3)抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)>v(放),在速率-时间图上,要注意看清曲线是
连续的还是跳跃的,分清渐变和突变,大变和小变。例如,升
高温度,v(吸)大增,v(放)小增;增大反应物浓度,v(正)突变,v(逆)渐变。
1.(2021 年浙江选考)一定温度下:在 N2O5 的四氯化碳溶液
(100 mL)中发生分解反应:2N2O5
4NO2+O2。在不同时刻
测量放出的 O2 体积,换算成 N2O5 浓度如下表:
A.600~1200 s,生成 NO2 的平均速率为 5.0×10-4 ml·L-1·s-1B.反应 2220 s 时,放出的 O2 体积为 11.8 L(标准状况)C.反应达到平衡时,v正(N2O5)=2v逆(NO2)D.推测上表中的 x 为 3930
2.(2020 年天津卷)理论研究表明,在 101 kPa 和 298 K 下,
HNC(g)异构化反应进程的能量变化如图所示。下
A.HCN 比 HNC 稳定
B.该异构化反应的ΔH=+59.3 kJ·ml-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热
解析:根据题图中信息得到 HCN 能量比 HNC 能量低,再根据物质能量越低越稳定,因此 HCN 比 HNC 稳定,A 正确;根据焓变等于生成物总能量减去反应物总能量,因此该异构化
反应的ΔH=59.3 kJ·ml-1-0=+59.3 kJ·ml-1,B 正确;根据
题图中信息得出该反应是吸热反应,因此正反应的活化能大于逆反应的活化能,C 正确;使用催化剂,不能改变反应的反应热,只改变反应路径,反应热只与反应物和生成物的总能量有关,D 错误。
3.(2021年湖南卷)铁的配合物离子(用[L-Fe-H]+表示)催
化某反应的一种反应机理和相对能量的变化情况如图所示:
A.该过程的总反应为 HCOOH
B.H+浓度过大或者过小,均导致反应速率降低C.该催化循环中 Fe 元素的化合价发生了变化D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定解析:由反应机理可知,HCOOH 电离出氢离子后,HCOO-与催化剂结合,放出二氧化碳,然后又结合氢离子转化为氢气,
所以化学方程式为 HCOOH
CO2↑+H2↑,A 正确;若
氢离子浓度过低,则反应Ⅲ→Ⅳ的反应物浓度降低,反应速率
减慢,若氢离子浓度过高,则会抑制用酸的电离,使甲酸根浓度降低,反应Ⅰ→Ⅱ速率减慢,所以氢离子浓度过高或过低,均导致反应速率减慢,B 正确;由反应机理可知,Fe 在反应过程中,化学键数目发生变化,则化合价也发生变化,C 正确;由反应进程可知,反应Ⅳ→Ⅰ反应所需的活化能最大,反应速率最慢,对该过程的总反应起决定作用,D 错误。
如图所示。下列说法不正确的是(
4.(2021 年广东卷) 反应 X===2Z 经 历 两 步 : ①X→Y ;②Y→2Z。反应体系中 X、Y、Z 的浓度 c 随时间 t 的变化曲线
A.a 为 c(X)随 t 的变化曲线B.t1 时,c(X)=c(Y)=c(Z)C.t2 时,Y 的消耗速率大于生成速率D.t3 后,c(Z)=2c0-c(Y)
解析:由题中信息可知,反应 X===2Z 经历两步:①X→Y;②Y→2Z。因此,题图中呈不断减小趋势的 a 线为 X 的浓度 c随时间 t 的变化曲线,呈不断增加趋势的线为 Z 的浓度 c 随时间 t 的变化曲线,先增加后减小的线为 Y 的浓度 c 随时间 t 的变化曲线。X 是唯一的反应物,随着反应的进行,其浓度不断减小,因此,由题图可知,a 为 c(X)随 t 的变化曲线,A 正确;由题图可知,分别代表 3 种不同物质的曲线相交于 t1 时刻,因此,t1 时 c(X)=c(Y)=c(Z),B 正确;由题图中信息可知,t2 时刻以后,Y 的浓度仍在不断减小,说明 t2 时刻反应两步仍在向
2024届高考化学一轮总复习第七章化学反应速率与化学平衡第一节化学反应速率课件: 这是一份2024届高考化学一轮总复习第七章化学反应速率与化学平衡第一节化学反应速率课件,共60页。PPT课件主要包含了不一定增大,物质的量,mol·,L-1·min-1,答案A,mol·L,起始浓度,转化浓度,min时浓度,答案B等内容,欢迎下载使用。
人教版高考化学一轮总复习课时质量评价25化学反应速率课件: 这是一份人教版高考化学一轮总复习课时质量评价25化学反应速率课件,共36页。
2023版高考化学一轮总复习第八章微专题九化学反应速率和平衡图像的分析课件: 这是一份2023版高考化学一轮总复习第八章微专题九化学反应速率和平衡图像的分析课件,共17页。












