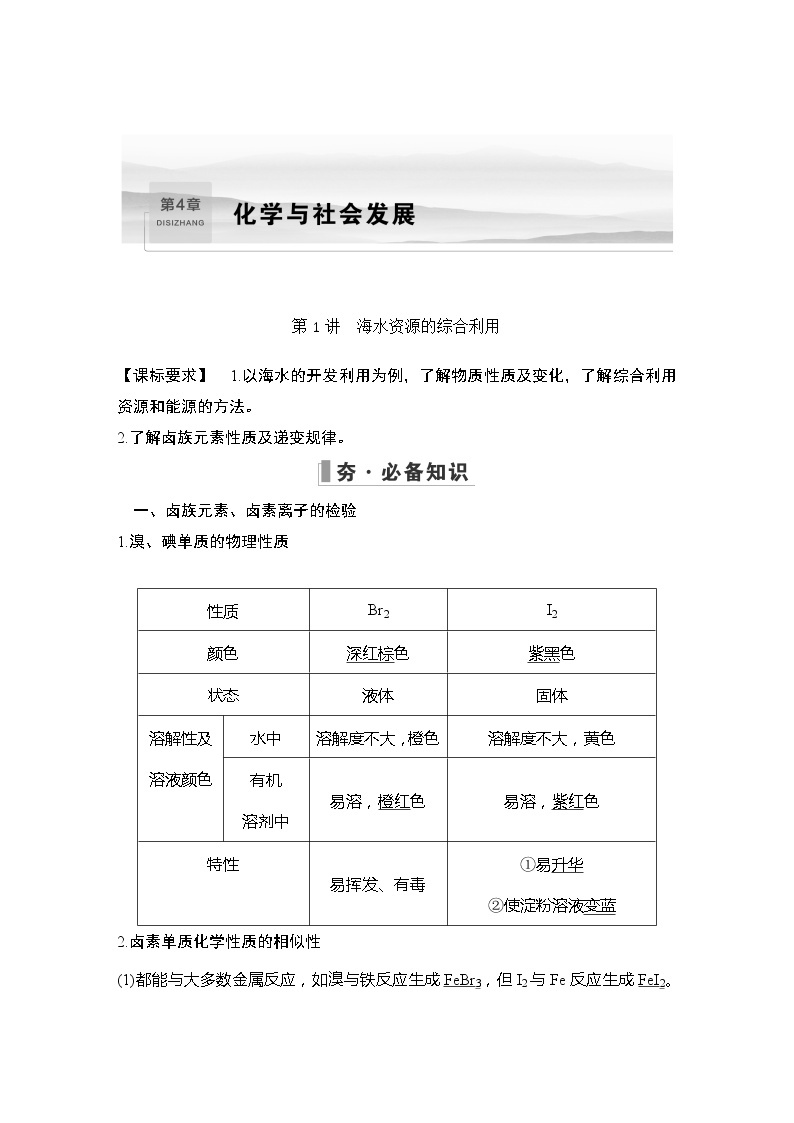
第1讲 海水资源的综合利用【课标要求】 1.以海水的开发利用为例,了解物质性质及变化,了解综合利用资源和能源的方法。2.了解卤族元素性质及递变规律。 一、卤族元素、卤素离子的检验1.溴、碘单质的物理性质2.卤素单质化学性质的相似性(1)都能与大多数金属反应,如溴与铁反应生成FeBr3,但I2与Fe反应生成FeI2。HF是弱酸,其他均为强酸(2)都能与H2反应生成HX(X代表F、Cl、Br、I)。(3)都能与水反应:X2+H2OHX+HXO(X代表Cl、Br、I)。(4)都能与碱溶液反应。3.卤素单质性质的递变性颜色�eq \o(――→,\s\up7(F2),\s\do5(淡黄绿色)�� Cl2,黄绿色) Br2,深红棕色) I2,紫黑色)))逐渐加深熔、沸点�eq \o(―――――――――――――――――――→,\s\up10(气体 气体 液体 固体))��逐渐升高密度―→逐渐增大氧化性―→逐渐减弱与H2化合由易到难4.卤素性质的特殊性(1)F无正价,F2与H2反应在暗处即爆炸,F2与水剧烈反应,化学方程式:2F2+2H2O===4HF+O2。(2)Br2是常温下唯一呈液态的非金属单质;液溴通常用水封保存,不能用橡胶塞。(3)CaX2中只有CaF2难溶于水,其他均易溶于水,AgX中只有AgF易溶于水,其他均难溶于水。5.卤素离子的检验(1)AgNO3溶液——沉淀法未知液�eq \o(――→,\s\up7( 滴加AgNO3溶液 ),\s\do5(和稀硝酸))��生成�eq \b\lc\{(\a\vs4\al\co1(白色沉淀,则有Cl-,淡黄色沉淀,则有Br-,黄色沉淀,则有I-))��(2)置换——萃取法未知液�eq \o(―――――――→,\s\up10(加适量新制饱和氯水),\s\do10(振荡))�� �eq \o(―――――――――――――→,\s\up10(加入CCl4(下层)或汽油(上层)),\s\do10(振荡、静置))��有机层呈�eq \b\lc\{(\a\vs4\al\co1(红棕色或橙红色,表明有Br-,紫色、浅紫色或紫红色,表明有I-))��(3)氧化——淀粉检验I-未知液�eq \o(――→,\s\up7(加入适量新制饱和氯水(双氧水)),\s\do5(振荡))���eq \o(――→,\s\up7(淀粉溶液),\s\do5(振荡))��蓝色溶液,表明有I-【诊断1】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。(1)加碘盐能使淀粉变蓝(×)(2)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I-(√)(3)卤素气态氢化物的水溶液都是强酸(×)(4)类比Fe与Cl2的反应判断Fe与I2反应时生成FeI3(×)二、碘、溴和镁的提取1.海带提碘(1)基本步骤实验室里,从海带灰中提取碘单质包括浸取、过滤、氧化、萃取四个步骤。(2)工艺流程(3)两种原理①主要的化学原理:2I-+Cl2===2Cl-+I2。②主要的物理原理:单质碘用苯或CCl4萃取、分液后用蒸馏法将碘与有机溶剂分开。(4)反萃取法提取碘碘与NaOH浓溶液发生反应:3I2+6NaOH===5NaI+NaIO3+3H2O。2.海水提溴(1)基本步骤从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤。(2)工艺流程(3)主要过程及反应原理3.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应由MgCl2·6H2O到无水MgCl2,必须在HCl的气流中加热,以抑制MgCl2水解。【诊断2】 判断下列叙述的正误(正确的划“√”,错误的划“×”)。(1)从海水中提取物质都必须通过化学反应才能实现(×)(2)从海带中提取碘时可用酒精作萃取剂(×)(3)海水蒸发制盐的过程中只发生化学变化(×)(4)从海水中提取溴的工艺流程中两次出现Br-�eq \o(――→,\s\up7(Cl2),\s\do5(氧化))��Br2的过程,其目的是对海水中的溴元素进行富集(√)考点一 卤族元素、卤素离子的检验【题组训练】1.下列有关卤素的说法错误的是 ( )A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝,4I-+O2+2H2O===2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度答案 A解析 元素的非金属性强弱与其对应的氢化物溶液的酸性强弱无关,可根据其最高价氧化物对应的水化物的酸性强弱进行比较,A错误;I2在KI溶液中存在平衡I2+I-I�eq \o\al(-,3)��,可使其溶解度增大,D正确。2.(双选)下列叙述中正确的是( )A.能使湿润的淀粉-KI试纸变成蓝色的物质一定是Cl2B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某浅黄色的溴水,加入CCl4振荡静置后,下层显橙红色答案 BD解析 还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A项错误;碘单质的CCl4溶液显紫红色,C项错误;CCl4的密度比水大,下层显橙红色,D项正确。“碘盐”中“碘”的检验方法“碘盐”中的“碘”是碘酸钾(KIO3),利用反应:IO�eq \o\al(-,3)��+5I-+6H+===3I2+3H2O,生成的I2遇淀粉变蓝色检验。其实验操作方法:①向洁净试管中加入少量袋装食盐,并加入适量白醋使其溶解,②用玻璃棒蘸取①中的少量液体滴到淀粉-KI试纸上,若观察到试纸变成蓝色,则说明该袋装食盐为加“碘”食盐。考点二 从海水中提取化学物质【题组训练】1.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的是( )A.①中反应的离子方程式:2I-+H2O2===I2+2OH-B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出C.③中得到的上层溶液中含有I-D.操作Z的名称是加热答案 C解析 反应为酸性环境,①中反应的离子方程式:2I-+2H++H2O2===I2+2H2O,故A错误;四氯化碳比水的密度大,在下层,②中分液时含I2的CCl4溶液从分液漏斗下口放出,故B错误;操作Z的名称是过滤,故D错误。2.从淡化海水中提取溴的流程如下:下列有关说法不正确的是( )A.X试剂可用Na2SO3饱和溶液B.步骤Ⅲ的离子方程式:2Br-+Cl2===2Cl-+Br2C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 LD.步骤Ⅳ包含萃取、分液和蒸馏答案 C解析 Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴的强,利用置换反应制取Br2,B正确;反应Ⅰ和反应Ⅲ均使用到Cl2,故制取1 mol Br2消耗2 mol 氯气,但未标明氯气所处的温度和压强,C错误;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D正确。 1.(双选)(高考题组合)下列说法正确的是( )A.(2021·浙江6月选考)工业上可用离子交换法提高海带中碘的提取率B.(2021·浙江1月选考)通常以海水提取粗食盐后的母液为原料制取溴C.(2021·广东卷)将溴水滴入KI溶液中,加入乙醇并振荡萃取溶液中生成的碘D.(2021·河北卷)加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强答案 AB解析 离子交换法可以很大程度地提取海水中的I-,还可以起到富集低浓度I-的作用,可以提高海水中碘的提取率,A正确;海水提取粗食盐后的母液属于浓缩的海水,其中溴化物的浓度较高,因此,通常以海水提取粗食盐后的母液为原料制取溴,B说法正确;乙醇与水互溶,不能作碘单质的萃取剂,C错误;HI的沸点低,易挥发加热NaI与浓H3PO4混合物发生反应生成HI利用的是高沸点酸制备低沸点酸的原理,D错误。2.(2021·湖南卷)一种工业制备无水氯化镁的工艺流程如下:下列说法错误的是 ( )A.物质X常选用生石灰B.工业上常用电解熔融MgCl2制备金属镁C.“氯化”过程中发生的反应为MgO+C+Cl2�eq \o(=====,\s\up7(高温))��MgCl2+COD.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2答案 D解析 苦卤水中含有大量镁离子,加入生石灰,生石灰与水反应生成氢氧化钙,氢氧化钙再与镁离子反应生成氢氧化镁,生石灰来源丰富、价格便宜,常用来做沉镁的沉淀剂,A说法正确;镁为活泼金属,工业上常用电解熔融氯化镁的方法来制备金属镁,B说法正确;根据题给流程图可知,“煅烧”氢氧化镁得到氧化镁,“氯化”过程中,加入碳和氯气与氧化镁反应,生成无水氯化镁和一种气体,根据原子守恒和化合价升降可得反应的化学方程式为MgO+C+Cl2�eq \o(=====,\s\up7(高温))��MgCl2+CO,C说法正确;向“煅烧”后所得氧化镁中加稀盐酸,得到氯化镁溶液,由于镁离子会发生水解反应Mg2++2H2OMg(OH)2+2H+,直接蒸发MgCl2溶液,生成的HCl挥发,最终得到的是氢氧化镁,而不是无水氯化镁,D说法错误。3.(2021·全国甲卷)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:(1)I2的一种制备方法如下图所示:①加入Fe粉进行转化反应的离子方程式为________________________,生成的沉淀与硝酸反应,生成________后可循环使用。②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为________;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是___________________________________________________________________。(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为____________________________________________。(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1 mol I2,消耗的KI至少为________ mol。I2在KI溶液中可发生反应:I2+I-I�eq \o\al(-,3)��。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是____________________________。答案 (1)①2AgI+Fe===2Ag+Fe2++2I-AgNO3 ②FeI2+Cl2===I2+FeCl2 I2、FeCl3 I2被进一步氧化(2)2IO�eq \o\al(-,3)��+5HSO�eq \o\al(-,3)��===I2+5SO�eq \o\al(2-,4)��+H2O+3H+ (3)4 防止单质碘析出解析 (1)①由流程分析可知,加入Fe粉进行转化反应的离子方程式是2AgI+Fe===2Ag+Fe2++2I-;生成的沉淀为Ag,Ag与HNO3反应生成AgNO3,AgNO3可以循环使用。②由于还原性:I->Fe2+,故通入Cl2的过程中,若氧化产物只有一种,该产物应是I2,此时反应的化学方程式是FeI2+Cl2===I2+FeCl2;若�eq \f(n(Cl2),n(FeI2))��=1.5,正好将Fe2+氧化为Fe3+,反应的化学方程式是2FeI2+3Cl2===2FeCl3+2I2;当�eq \f(n(Cl2),n(FeI2))��>1.5后,单质I2的收率会降低,说明Cl2可以进一步将I2氧化为高价态的碘的化合物。(2)NaIO3具有氧化性,NaHSO3具有还原性,二者发生氧化还原反应生成NaI和Na2SO4,反应的离子方程式是IO�eq \o\al(-,3)��+3HSO�eq \o\al(-,3)��===3SO�eq \o\al(2-,4)��+I-+3H+;NaI和NaIO3在酸性条件下,继续发生氧化还原反应生成I2,反应的离子方程式是5I-+IO�eq \o\al(-,3)��+6H+===3I2+3H2O,故制备I2的总反应的离子方程式是2IO�eq \o\al(-,3)��+5HSO�eq \o\al(-,3)��===I2+5SO�eq \o\al(2-,4)��+H2O+3H+。(3)由题给信息可推断出CuSO4和KI发生反应的化学方程式是2CuSO4+4KI===2CuI↓+I2+2K2SO4,故若生成1 mol I2,消耗的KI至少为4 mol;I�eq \o\al(-,3)��的生成增大了I2在水中的溶解度,反应中加入过量的KI可以防止单质碘析出。1.下列关于卤素的叙述正确的是( )①卤素的钾盐中,最易被氧化的是氟化钾②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯③溴化银具有感光性,碘化银不具有感光性④某溶液与淀粉-KI溶液反应出现蓝色,则证明该溶液是氯水或溴水⑤氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成⑥氯气跟水反应时,水既不是氧化剂也不是还原剂A.①③⑤ B.②③⑥C.②⑤⑥ D.①③④答案 C解析 易被氧化的物质应具有较强的还原性,卤素离子中,I-的还原性最强,故卤素的钾盐中,最易被氧化的是KI,①错误;卤化银中除AgF外均有感光性,③错误;能与淀粉-KI溶液反应出现蓝色现象的,除氯水或溴水外,还可以是碘水等,④错误。2.下列叙述中正确的是( )A.氯水久置过程中,氯水的氧化性增强,酸性减弱B.用硝酸酸化的AgNO3溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.向某溶液中加入CCl4,振荡、静置后,CCl4层显紫红色,证明原溶液中存在�I-D.某浅黄色的溴水,加CCl4振荡、静置后,上层显橙红色答案 B3.鉴别NaCl溶液、NaBr溶液、NaI溶液可以选用的试剂是( )①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液 ⑤氯水、苯 ⑥CCl4、淀粉溶液A.①②④ B.②③⑥C.②④⑤ D.④⑤⑥答案 C解析 ①无法鉴别三种溶液,③无法鉴别NaCl和NaBr溶液,⑥无法鉴别三种溶液。4.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强B.F处棉花球变成蓝色,说明Br2的氧化性比I2强C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O答案 B解析 在F处,可能是未反应完的Cl2与KI发生反应置换出I2,使淀粉变蓝色,不能说明Br2的氧化性比I2强。5.(2021·昆明模拟)下列从海带中提取碘的实验操作或现象错误的是( )A.用甲装置灼烧酒精润湿的海带碎片至灰烬B.将海带灰在烧杯中加水煮沸后用乙装置过滤C.滤液滴加稀硫酸及双氧水后,用CCl4按丙装置萃取,上层溶液呈紫红色 D.用丁装置进行减压蒸馏,分离CCl4与碘单质答案 C解析 A.灼烧在坩埚中进行,则甲装置可灼烧酒精润湿的海带碎片至灰烬,故A正确;B.过滤可分离出含碘离子的溶液,则用乙装置过滤,故B正确;C.四氯化碳的密度比水的密度大,则丙装置萃取,下层溶液呈紫红色,故C错误;D.减压蒸馏可降低沸点,则丁装置进行减压蒸馏可分离CCl4与碘单质,故D正确。6.工业海水提溴时,下列操作步骤与目的均正确的是( )答案 C解析 A.浓缩海水提高c(Br-),n(Br-)不变,故A错误;B.通入氯气发生Cl2+2Br-===Br2+2Cl-,氧化溴离子,故B错误;C.溴易挥发,热空气可吹出溴,故C正确;D.CCl4萃取可分离溴与水溶液,故D错误。7.(2021·徐州模拟)一种从卤水中提取碘的实验流程如图,下列说法错误的是( )A.①~④是为了富集碘B.③、④、⑥工艺过程主要发生物理变化C.⑤的反应中,氧化剂与还原剂物质的量之比为1∶6D.⑥可用如图所示装置进行答案 B解析 设计步骤①~④的目的是富集碘,A项正确;过程④解脱的目的是用SO�eq \o\al(2-,3)��吸收单质I2,发生的反应为SO�eq \o\al(2-,3)��+I2+H2O===SO�eq \o\al(2-,4)��+2I-+2H+,B项错误;过程⑤的离子方程式是ClO�eq \o\al(-,3)��+6I-+6H+===3I2+Cl-+3H2O,其中氧化剂和还原剂的物质的量之比为1∶6,C项正确;碘加热易升华,图中加热可在圆底烧瓶外底部收集碘,D项正确。8.海水开发利用的部分过程如图所示。下列说法错误的是( )A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产中常选用NaOH作为沉淀剂D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收答案 C解析 A项,向苦卤中通入Cl2时发生反应Cl2+2Br-===2Cl-+Br2,故其目的是为了提取溴,正确;B项,可将粗盐溶解、过滤除去难溶性杂质,然后向滤液中加入沉淀剂,过滤后调节滤液pH以除去可溶性杂质,最后重结晶可得精盐,正确;C项,工业生产中常选用廉价的Ca(OH)2作为沉淀剂,错误;D项,由于通入Cl2后所得溶液中Br2的浓度很小,因此利用Br2的挥发性,可先用热空气和水蒸气吹出Br2,再用SO2将其还原为HBr进行富集,正确。9.(2021·丰台模拟)“空气吹出法”海水提溴的工艺流程如图。下列说法不正确的是( )A.向浓缩海水中通入Cl2时,溴元素的化合价升高被氧化B.空气吹出法利用了溴单质的挥发性C.在吸收塔中Br2与SO2发生反应以达到富集目的D.从蒸馏塔中出来后的操作为萃取答案 D解析 A.浓缩酸化后的海水中含溴离子,通入氯气发生2Br-+Cl2===2Cl-+Br2,溴元素的化合价升高被氧化,故A正确;B.溴单质易挥发,可利用空气吹出,故B正确;C.海水中溴离子浓度较低,经过吸收塔后Br2与SO2发生反应,溴元素得到富集,故C正确;D.在蒸馏塔中氯气与HBr反应生成溴,然后蒸馏分离出溴,故D错误。10.向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述不正确的是( )A.原溶液中的Br-不一定被氧化B.通入氯气之后原溶液中的Fe2+一定被氧化C.不能确定通入氯气之后的溶液中是否存在Fe2+D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生淡黄色沉淀答案 D解析 还原性:I- >Fe2+>Br-,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明Fe2+部分或全部被氧化,Br-可能被氧化,A、B正确;通入氯气之后原溶液中的Fe2+部分或全部被氧化,所以不能确定通入氯气之后的溶液中是否存在Fe2+,C正确;若Br-全部被氧化生成Br2,则萃取后加入硝酸银,没有淡黄色沉淀生成,D错误。11.海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO�eq \o\al(2-,4)��等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):_____________________________________。(2)①电解饱和食盐水的化学方程式为_________________________________。②制取MgCl2的过程中涉及反应:MgCl2·6H2O�eq \o(=====,\s\up7(△))��MgCl2+6H2O,该反应要在HCl气氛中进行,原因是___________________________________________。(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式: _____________________________________________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为________________。(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是________________________________________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用________方法得到单质Br2。答案 (1)BaCl2、NaOH、Na2CO3、HCl(合理即可)(2)①2NaCl+2H2O�eq \o(=====,\s\up7(电解))��Cl2↑+H2↑+2NaOH②防止MgCl2水解(3)Br2+SO2+2H2O===2Br-+4H++SO�eq \o\al(2-,4)�� Cl2>Br2>SO2(4)3Br2+3CO�eq \o\al(2-,3)��===5Br-+BrO�eq \o\al(-,3)��+3CO2↑ 蒸馏解析 (1)SO�eq \o\al(2-,4)��、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,再通过过滤除去,Na2CO3溶液能除去Ca2+和过量的Ba2+,盐酸能除去过量的CO�eq \o\al(2-,3)��和OH-,所以应先加BaCl2溶液再加NaOH溶液和Na2CO3溶液,且NaOH与Na2CO3加入的先后顺序可互换,最后加入盐酸,所以正确的顺序为BaCl2、NaOH、Na2CO3、HCl或BaCl2、Na2CO3、NaOH、HCl。(2)①电解饱和食盐水的化学方程式为2NaCl+2H2O�eq \o(=====,\s\up7(电解))��Cl2↑+H2↑+2NaOH。②氯化镁在水中易发生水解,为抑制其水解,氯化镁晶体应在氯化氢气流中脱水。(3)苦卤中通入Cl2已经置换出Br2,吹出后用SO2吸收Br2,Br2转化为Br-,再用Cl2置换,第一次吹出的Br2浓度太低,SO2吸收主要起到富集溴的作用;在反应Cl2+2Br-===Br2+2Cl-中,氧化性:Cl2>Br2,在反应SO2+2H2O+Br2===H2SO4+2HBr中,氧化性:Br2>SO2,故氧化性强弱顺序为Cl2>Br2>SO2。(4)吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为3Br2+3CO�eq \o\al(2-,3)��===5Br-+BrO�eq \o\al(-,3)��+3CO2↑,最后再用H2SO4处理得到Br2,加入CCl4进行Br2的萃取,最后通过蒸馏操作分离得到溴单质。12.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……(1)A中产生黄绿色气体,其电子式是____________。(2)验证氯气的氧化性强于碘的实验现象是________________________。(3)B中溶液发生反应的离子方程式是__________________________________。(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____________________。(5)过程Ⅲ实验的目的是______________________________________________。答案 (1) (2)湿润的淀粉-KI试纸变蓝(3)Cl2+2Br-===Br2+2Cl-(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰解析 A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI===2KCl+I2、Cl2+2NaBr===2NaCl+Br2、Cl2+2NaBr===2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI===2KBr+I2。实验过程Ⅲ,当B中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰。13.(双选)(2021·龙岩模拟)海洋中有丰富的资源,如图为海水利用的部分过程。下列有关说法不正确的是( )A.由反应①可知:相同温度下,NaHCO3的溶解度小于NaCl B.工业上通过电解饱和MgCl2溶液制取金属镁 C.反应②的离子方程式为:Br2+SO2+2H2O===SO�eq \o\al(2-,4)��+2Br-+4H+D.粗盐中含有的Mg2+、SO�eq \o\al(2-,4)��等杂质离子,可通过依次加入BaCl2溶液、NaOH溶液、盐酸等试剂加以去除答案 BD解析 A.①为NaCl溶液中通氨气、二氧化碳,析出NaHCO3,可知碳酸氢钠的溶解度小于氯化钠,故A正确;B.电解熔融氯化镁生成镁单质和氯气,故B错误;C.②中二氧化硫与溴反应生成HBr,离子反应为Br2+SO2+2H2O===SO�eq \o\al(2-,4)��+2Br-+4H+,故C正确;D.粗盐中含有的Mg2+、SO�eq \o\al(2-,4)��等杂质离子,先转化为沉淀,可通过依次加入BaCl2溶液、NaOH溶液,但是过量的BaCl2溶液无法除去,故D错误。14.(2021·襄阳模拟)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )A.欲获得淡化海水,离子交换膜a、b分别选择阴、阳离子交换膜 B.通电时,阴极区附近溶液的pH增大 C.电解NaCl溶液可制备金属钠 D.海水中的重水(含HDO 0.03%)与H2O化学性质不同答案 B解析 A.左侧阳极上氢氧根离子失去电子,钠离子向浓缩室移动;右侧阴极上氢离子得到电子,氯离子向浓缩室移动,则离子交换膜a、b分别选择阳、阴离子交换膜,故A错误;B.阴极上氢离子得到电子,氢氧根离子增多,则阴极区附近溶液的pH增大,故B正确;C.电解氯化钠溶液生成NaOH、氢气、氯气,应电解熔融氯化钠生成Na,故C错误;D.HDO与H2O均为水,H、D互为同位素,化学性质相似,故D错误。15.(2021·梅州模拟)某研究性学习小组同学取V L浓缩的海水,用如图1所示装置模拟工业法提溴。回答下列问题: (1)装置A可用于实验室制备氯气,装置B是SO2贮气瓶,则Q中的溶液为________。(2)溴的富集过程:①通入氯气与通入热空气的顺序是先通________________,通入氯气时K1、K2、K3的关、开方式是________________。②装置D的作用是_________________________________________,通入SO2时装置E中发生反应的化学方程式为_______________________________________。(3)溴的精制:①待装置E中Br-全部转化为单质后,再利用如图2中的________(填字母)装置进行蒸馏即可得到纯溴。②假设最终得到m g纯溴,实验中溴的利用率为b%,则浓缩海水中c(Br-)=________。(4)某苦卤水中主要含有Mg2+、SO�eq \o\al(2-,4)��、K+、Cl-等。根据图的溶解度曲线判断,从中获得K2SO4晶体的最佳方案是先加入适量________试剂,过滤,________析晶。所得晶体中含有少量KCl杂质,简述实验检验其中Cl-的实验操作与现象___________________________________________________________________。答案 (1)饱和NaHSO3溶液 (2)①Cl2或氯气 关闭K1、K3,打开K2 ②吸收尾气,防止其污染空气 SO2+Br2+2H2O===2HBr+H2SO4(3)①C ②�eq \f(1.25m,bV)�� mol/L (4)KOH 蒸发取样于试管中,加少量水充分溶解,滴加硝酸酸化的AgNO3溶液,产生白色沉淀解析 (1)装置A为固液加热装置,实验室用浓盐酸与二氧化锰在加热的条件下制备氯气,其反应原理的离子方程式为MnO2+4H++2Cl-�eq \o(=====,\s\up7(△))��Mn2++Cl2↑+2H2O,装置B是贮气瓶,酸性气体难溶于对应酸式盐溶液,在取用时,可打开活塞向集气瓶中加入饱和溶液后可将SO2排出。(2)①热空气的作用是将溴单质从溶液中吹出,从而达到富集溴的目的,因此向溶液中先通一段时间氯气,将溴离子转化为溴单质,再通入热空气,将溴从溶液中分离出来;通入氯气时不能同时通热空气,应关闭K1,防止氯气进入装置E影响后续制取结果,应关闭K3,多余的氯气有毒,不能排放到大气中,应打开K2用碱液吸收;②装置D的作用是吸收尾气,防止其污染空气,通入SO2时装置E中发生反应的化学方程式为SO2+Br2+2H2O===2HBr+H2SO4;(3)①蒸馏时温度计的水银球在蒸馏烧瓶的支管口处,冷水下进上出,可知A、D错误,B中选球形冷凝管易残留馏分,只有C合理;②假设最终得到m g纯溴,实验中溴的利用率为b%,由溴原子守恒可知,浓缩海水中c(Br-)=�eq \f(\f(m g,b%×80 g/mol),V L)��=�eq \f(1.25m,bV)�� mol /L 。(4)苦卤水中含有Mg2+,除去Mg2+,且不带入新杂质时,可加入KOH溶液将Mg2+转化为Mg(OH)2沉淀、过滤除去,得到的滤液为KCl和K2SO4的混合溶液,由于KCl的溶解度大于对应温度下的K2SO4,且K2SO4的溶解度受温度影响变化不大,可采用蒸发结晶法、趁热过滤得到K2SO4晶体;所得K2SO4晶体中含有少量KCl杂质,可通过检验Cl-的存在加以验证,实验操作为:取样于试管中,加少量水充分溶解,滴加硝酸酸化的AgNO3溶液,产生白色沉淀。�性质�Br2�I2�颜色�深红棕色�紫黑色�状态�液体�固体�溶解性及溶液颜色�水中�溶解度不大,橙色�溶解度不大,黄色�有机溶剂中�易溶,橙红色�易溶,紫红色�特性�易挥发、有毒�①易升华②使淀粉溶液变蓝�制熟石灰�CaCO3�eq \o(=====,\s\up7(高温))��CaO+CO2↑,CaO+H2O===Ca(OH)2�沉淀�Mg2++2OH-===Mg(OH)2↓�酸化�Mg(OH)2+2HCl===MgCl2+2H2O�蒸发结晶�析出MgCl2·6H2O�脱水�在氯化氢气流中使MgCl2·6H2O脱水制得无水氯化镁�电解�电解熔融氯化镁制得镁:MgCl2(熔融)�eq \o(=====,\s\up7(电解))��Mg+Cl2↑�A�B�C�D�步骤�浓缩海水�通Cl2�鼓入热空气�CCl4萃取�目的�提高n(Br-)�还原Br-�使Br2挥发�使Br2溶解�