


























2023版 创新设计 高考总复习 化学 人教版第十二章 物质结构与性质(选考)
展开一、共价键1.本质和特征 共价键的本质是在原子之间形成共用电子对(电子云重叠),特征是具有______性和______性。2.分类 (1)根据原子轨道的重叠方式分为____键和____键。 (2)根据共用电子对是否偏移分为______键和________键。 (3)根据原子间共用电子对的数目分为单键、双键和三键。 (4)根据共用电子对的形成方式分为一般共价键和________。
3.键参数 (1)
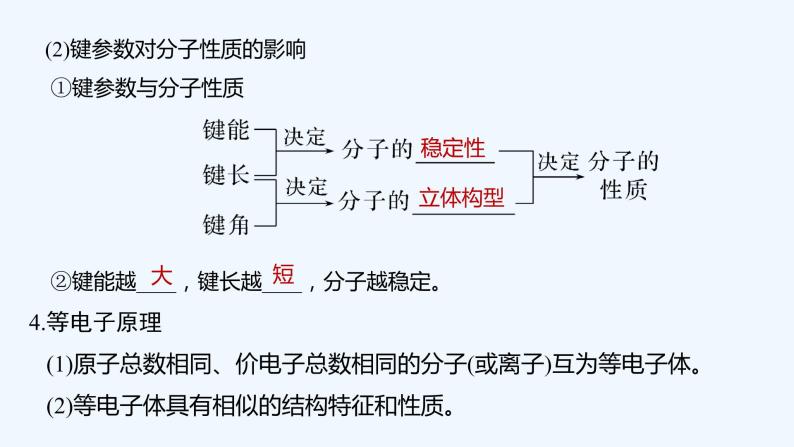
(2)键参数对分子性质的影响 ①键参数与分子性质 ②键能越____,键长越____,分子越稳定。4.等电子原理 (1)原子总数相同、价电子总数相同的分子(或离子)互为等电子体。 (2)等电子体具有相似的结构特征和性质。
答案 (1)× (2)× (3)× (4)× (5)√
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
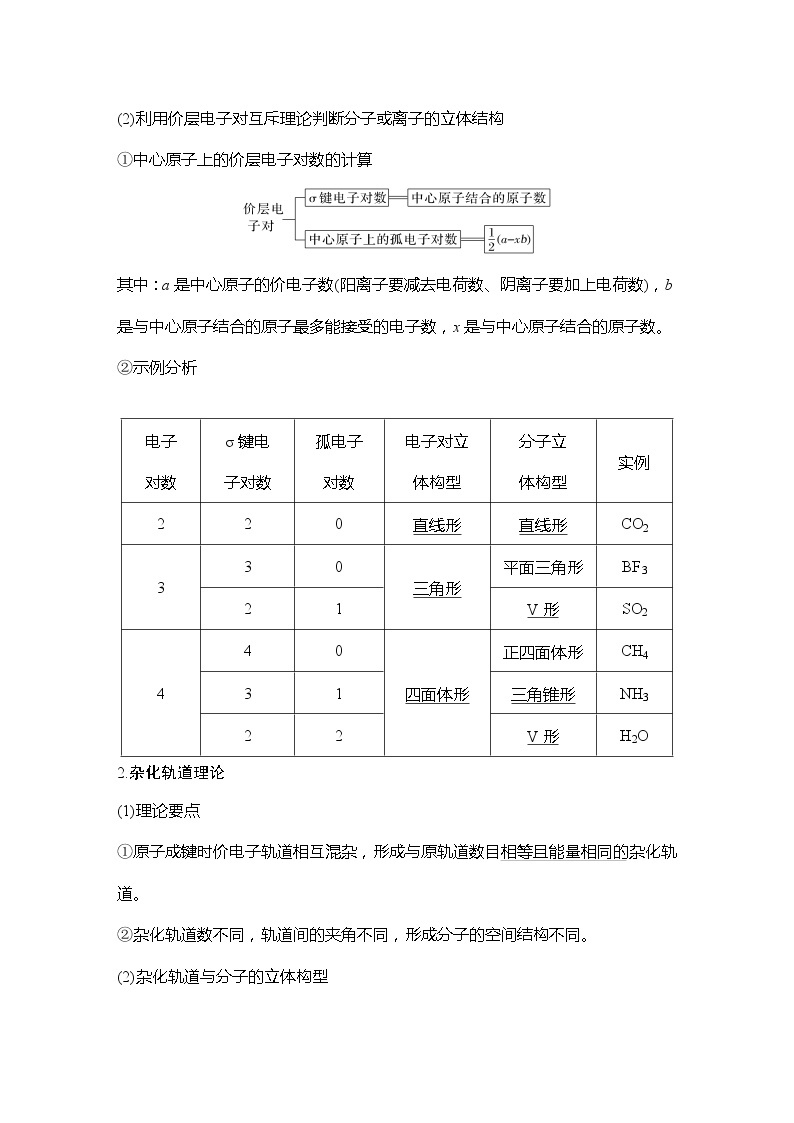
二、分子的立体结构和配位键1.价层电子对互斥理论 (1)理论要点 ①价层电子对在空间上彼此相距最远时,排斥力最小,体系的能量最低。 ②孤电子对的排斥力较大,孤电子对越多,排斥力越强,键角越小。 (2)利用价层电子对互斥理论判断分子或离子的立体结构 ①中心原子上的价层电子对数的计算
其中:a是中心原子的价电子数(阳离子要减去电荷数、阴离子要加上电荷数),b是与中心原子结合的原子最多能接受的电子数,x是与中心原子结合的原子数。
2.杂化轨道理论 (1)理论要点 ①原子成键时价电子轨道相互混杂,形成与原轨道数目相等且能量相同的杂化轨道。 ②杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。
(2)杂化轨道与分子的立体构型
(1)孤电子对分子或离子中没有跟其他原子共用的电子对。(2)配位键①含义:成键原子一方提供__________,另一方提供________形成共价键。
(3)配合物的组成以[Cu(NH3)4]SO4为例
(1)价层电子对互斥理论中,π键的电子对数不计入中心原子的价层电子对数( )(2)价层电子对互斥理论中价电子的构型就是分子的构型( )(3)NH3分子为三角锥形,N原子发生sp2杂化( )(4)中心原子是sp杂化的,其分子构型不一定为直线形( )(5)分子或离子中,中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构( )答案 (1)√ (2)× (3)× (4)× (5)×
(1)概念:物质分子之间普遍存在的相互作用力。(2)分类:范德华力和氢键。(3)强弱:范德华力____氢键____化学键。(4)范德华力①一般来说,____________相似的物质,随着______________的增加,范德华力逐渐______。②范德华力主要影响物质的熔点、沸点、硬度等物理性质。范德华力越强,物质的熔点、沸点______,硬度______。
三、分子间作用力和分子性质1.分子间作用力
(5)氢键①形成:已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力。②表示方法:________________。③特征:具有一定的______性和______性。④分类:氢键包括________氢键和________氢键两种。⑤分子间氢键使物质的熔、沸点______,对电离和溶解度等产生影响。
(1)极性分子与非极性分子极性分子正负电荷中心________。非极性分子正负电荷中心______。(2)物质的溶解性①“相似相溶”的规律:非极性溶质一般能溶于________溶剂,极性溶质一般能溶于______溶剂。②随着溶质分子中憎水基个数的增多,溶质在水中的溶解度______。
(1)手性异构:具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为镜像,却在三维空间里__________的现象。(2)手性分子:具有____________的分子。(3)手性碳原子:在有机物分子中,连有____________________的碳原子。 含有手性碳原子的分子是手性分子,如 。
对于同一种元素的无机含氧酸来说,该元素的化合价越高,其含氧酸的酸性越____。如果把含氧酸的通式写成(HO)mROn,R相同时,n值越大,酸性越____。
4.无机含氧酸分子的酸性
答案 (1)× (2)× (3)× (4)× (5)× (6)×
考点二 分子(或离子)立体结构的判断
考点一 共价键类型的判断和应用
考点三 分子间作用力与分子的性质
题组一 共价键的类别及判断1.(2021·四川自贡模拟)下列说法中不正确的是 ( )
2.下列十种物质:①CH4 ②CH3CH2OH ③N2 ④HCl ⑤CO2 ⑥CH3CH3 ⑦C2H4 ⑧C2H2 ⑨H2O2 ⑩HCHO 请按要求回答下列问题(填写编号): (1)只有σ键的有________,既有σ键又有π键的有________。 (2)只含有极性键的化合物有________,既含有极性键,又含有非极性键的化合物有________。 (3)含有双键的有________,含有三键的有________。 答案 (1)①②④⑥⑨ ③⑤⑦⑧⑩ (2)①④⑤⑩ ②⑥⑦⑧⑨ (3)⑤⑦⑩ ③⑧
解析 十种物质的结构式分别
根据以下两点判断化学键类型:①单键只有σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键;②同种元素原子之间形成的共价键是非极性键,不同种元素原子之间形成的共价键是极性键。
σ键和π键的分析与判断❶σ键、π键的判断:单键只有一个σ键;双键是一个σ键一个π键;三键是一个σ键两个π键。❷成键原子半径越大,越难形成π键,如Si等难形成双键。❸σ键一般比π键稳定,但N2中π键较稳定。❹并不是所有的共价键都有方向性,如s-s σ键没有方向性。❺原子形成共价键时优先形成σ键。❻配位键也属于σ键。
题组二 键参数及应用3.下列说法中正确的是( )
A.分子的键长越长,键能越低,分子越稳定B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间不能形成共价键C.水分子可表示为H—O—H,分子的键角为180°D.H—O键键能为462.8 kJ·ml-1,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ
4.已知几种共价键的键能如下:
下列说法错误的是( )A.键能:N≡N>N===N>N—NB.H(g)+Cl(g)===HCl(g) ΔH=-431.8 kJ·ml-1C.H—N键能小于H—Cl键能,所以NH3的沸点高于HClD.2NH3(g)+3Cl2(g)===N2(g)+6HCl(g)ΔH=-463.9 kJ·ml-1
解析 A项,三键键长小于双键键长小于单键键长,键长越短,键能越大,所以键能:N≡N>N===N>N—N,正确;B项,H(g)+Cl(g)===HCl(g)的焓变为H—Cl键能的相反数,则ΔH=-431.8 kJ·ml-1,正确;C项,NH3的沸点高于HCl是由于NH3形成分子间氢键,而HCl不能,键能不是主要原因,错误;D项,根据ΔH=∑E(反应物)-∑E(生成物),则2NH3(g)+3Cl2(g)===N2(g)+6HCl(g) ΔH=6E(N—H)+3E(Cl—Cl)-E(N≡N)-6E(H—Cl)=-463.9 kJ·ml-1,正确。
题组三 大π键5.B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误 的是 ( ) A.其熔点主要取决于所含化学键的键能 B.形成大π键的电子全部由N提供 C.分子中B和N的杂化方式相同 D.分子中所有原子共平面
解析 无机苯是分子晶体,其熔点主要取决于分子间的作用力,A错误;B原子最外层3个电子,与其他原子形成3个σ键,N原子最外层5个电子,与其他原子形成3个σ键,还剩余2个电子,故形成大π键的电子全部由N原子提供,B正确;无机苯与苯为等电子体,分子中含有大π键,故分子中B、N原子的杂化方式为sp2杂化,C正确;无机苯与苯为等电子体,分子中含有大π键,故分子中B、N原子的杂化方式为sp2杂化,所以分子中所有原子共平面,D正确。
【典例1】 (2021·湖北荆门模拟)用价层电子对互斥理论预测H2Se和NF3的立 体结构,两个结论都正确的是 ( ) A.直线形 三角锥形 B.V形 平面三角形 C.直线形 平面三角形D.V形 三角锥形
判断分子(或离子)立体构型“三步曲”第一步:确定中心原子上的价层电子对数价层电子对数=孤电子对数+σ键数=孤电子对数+中心原子结合的原子数第二步:确定价层电子对的立体构型价层电子对数为4的呈四面体结构,价层电子对数为3的为平面三角形结构,价层电子对数为2的为直线形结构(价层电子对数为5、6的分别为三角双锥、正八面体)。
第三步:确定分子或离子立体构型根据成键电子对数和孤电子对数,确定相应分子的立体构型,即没有孤电子对的分子(或离子)与价层电子对的立体构型一致,含有孤电子对的,去掉孤电子对得到分子(或离子)的立体构型。
题组一 杂化类型和空间构型的判断1.(2021·四川自贡模拟)下列中心原子的杂化轨道类型和分子几何构型不正确的是 ( ) A.PCl3中P原子为sp3杂化,三角锥形 B.BCl3中B原子为sp2杂化,平面三角形 C.CS2中C原子为sp杂化,直线形 D.H2S中S原子为sp杂化,直线形
2.根据价层电子对互斥理论填空:
(1)OF2分子中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为________杂化,VSEPR模型为________,分子的立体构型为________。(2)BF3分子中,中心原子上的σ键电子对数为________,孤电子对数为________,价层电子对数为________,中心原子的杂化方式为________杂化,VSEPR模型为________,分子的立体构型为________。
答案 (1)2 2 4 sp3 四面体形 V形(2)3 0 3 sp2 平面三角形 平面三角形解析 (1)O原子最外层有6个电子,F原子最外层有7个电子。OF2分子中, O和F之间形成单键,中心原子为O原子,与2个F原子形成σ键,故σ键电子对数为2,孤电子对数为(6-2×1)÷2=2,价层电子对数为σ键电子对数与孤电子对数之和,即2+2=4,中心原子的杂化方式为sp3杂化,VSEPR模型为四面体形,分子的立体构型为V形。(2)B的最外层有3个电子,F的最外层有7个电子。BF3分子中,中心原子上的σ键电子对数为3,孤电子对数为0,价层电子对数为3,中心原子的杂化方式为sp2杂化,VSEPR模型为平面三角形,分子的立体构型为平面三角形。
判断分子中心原子杂化类型的“四方法”❶根据价层电子对数判断
❷根据π键数目判断π键数目0,1,2,分别为sp3、sp2和sp杂化。❸根据杂化轨道之间的夹角判断。若杂化轨道之间的夹角为109.5°,则分子或离子的中心原子发生sp3杂化;若杂化轨道之间的夹角为120°,则分子或离子的中心原子发生sp2杂化;若杂化轨道之间的夹角为180°,则分子或离子的中心原子发生sp杂化。❹根据结构(简)式判断在结构(简)式中,若C、N等原子形成单键时为sp3杂化、双键时为sp2杂化、三键时为sp杂化。
题组二 键角大小的判断3.根据题目要求填空。
答案 (1)①> < ②< < > ③> > ④< < (2)> 双键斥力大于单键斥力
键角大小比较的解题流程
题组三 配位键和配合物4.(1)配位化学创始人维尔纳发现,取CCl3·6NH3(黄色)、CCl3·5NH3(紫红色)、CCl3·4NH3(绿色)和CCl3·4NH3(紫色)四种化合物各1 ml,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 ml、2 ml、 1 ml和1 ml。 ①请根据实验事实用配合物的形式写出它们的化学式。 CCl3·6NH3___________________,CCl3·4NH3(绿色和紫色) __________________。 ②上述配合物中,中心离子的配位数都是_________________________。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色,该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以以其他个数比配合,请按要求填空:①Fe3+与SCN-反应时,Fe3+提供________,SCN-提供________,二者通过配位键结合。②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1∶1配合所得离子显红色,含该离子的配合物的化学式是___________________________。
答案 (1)①[C(NH3)6]Cl3 [C(NH3)4Cl2]Cl ②6 (2)①空轨道 孤电子对 ②[Fe(SCN)]Cl2解析 (1)①每个CCl3·6NH3分子中有3个Cl-为外界离子,配体为6个NH3,化学式为[C(NH3)6]Cl3;每个CCl3·4NH3(绿色和紫色)分子中有1个Cl-为外界离子,配体为4个NH3和2个Cl-,化学式均为[C(NH3)4Cl2]Cl。②这几种配合物的化学式分别是[C(NH3)6]Cl3、[C(NH3)5Cl]Cl2、[C(NH3)4Cl2]Cl,其配位数都是6。(2)①Fe3+与SCN-反应生成的配合物中,Fe3+提供空轨道,SCN-提供孤电子对,二者通过配位键结合。②Fe3+与SCN-以个数比1∶1配合所得离子为[Fe(SCN)]2+,故FeCl3与KSCN在水溶液中反应生成[Fe(SCN)]Cl2与KCl。
【典例2】 已知H和O可以形成H2O和H2O2两种化合物,试根据有关信息完 成下列问题: (1)水是维持生命活动所必需的一种物质。 ①1 ml冰中有________ml氢键。 ②用球棍模型表示的水分子结构是________。
(2)已知H2O2分子的结构如图所示:H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。试回答:
①H2O2分子的电子式是________________,结构式是____________________________。②H2O2分子是含有________键和________键的________(填“极性”或“非极性”)分子。
③H2O2难溶于CS2,简要说明理由: _________________________________。④H2O2中氧元素的化合价是________,简要说明原因____________________。
解析 (1)在冰中,每个水分子与周围的4个水分子形成4个氢键,按“均摊法”计算,相当于每个水分子有2个氢键;水分子为V形结构。(2)由H2O2的立体构型图可知,H2O2是极性分子,分子内既有极性键,又有非极性键,而CS2为非极性分子,根据“相似相溶”规律,H2O2难溶于CS2。
题组一 范德华力、氢键对物质性质的影响1.(2021·福建厦门模拟)下列说法错误的是 ( ) A.甘油和水可以任意比例互溶 B.H2O的沸点高于HF, 是因为前者的氢键作用较大
解析 甘油为丙三醇,可与水以任意比例互溶,A正确;水的沸点比氢氟酸高,是因为等物质的量情况下,前者比后者含有的氢键数目多,但氢键作用力氢氟酸比较高,B错误;氢氟酸水溶液中共有两种不同的氢原子,可以分别与F、O原子形成氢键,故氢氟酸水溶液中氢键类型有四种,C正确;邻羟基苯甲醛易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,分子内氢键使分子熔点降低,D正确。
(1)HCHO分子的空间构型为________形,它与H2加成后,加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)_______________________________。(2)S位于周期表中________族,该族元素氢化物中,H2Te比H2S沸点高的原因是_____________________________________________,H2O比H2Te沸点高的原因是__________________________________________。(3)有一类组成最简单的有机硅化合物叫硅烷。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_____________________________。
(4)氨是一种易液化的气体,请简述其易液化的原因: ___________________。(5)硫的氢化物在乙醇中的溶解度小于氧的氢化物的原因是______________________________________________________________________。
答案 (1)平面三角 加成产物CH3OH分子之间能形成氢键(2)ⅥA 两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强 两者均为分子晶体,H2O分子之间存在氢键(3)硅烷为分子晶体,随相对分子质量增大,分子间作用力增强,熔、沸点升高(4)氨分子间存在氢键,分子间作用力大,因而易液化(5)H2O与乙醇分子间能形成氢键
题组二 分子的极性和手性3.(2021·广西防城港模拟)下列关于CS2、SO2、NH3三种物质的说法正确的是 ( ) A.CS2在水中的溶解度很小,是由于其属于极性分子 B.SO2和NH3均易溶于水,原因之一是它们都是极性分子 C.CS2为非极性分子,在三种物质中熔沸点最低 D.NH3在水中溶解度很大只是因为NH3是极性分子
解析 根据“相似相溶”原理,CS2在水中的溶解度很小,水是极性分子,则CS2是非极性分子,故A错误;由于SO2和NH3都是极性分子,水也是极性分子,根据“相似相溶”原理,二者均易溶于水,故B正确;由于CS2常温下是液体,SO2和NH3常温下是气体,CS2的熔沸点最高,故C错误;NH3在水中溶解度很大,除了由于NH3分子有极性外,还因为NH3分子和H2O分子之间可以形成氢键,故D错误。
4.下列说法正确的是( )
A.甘油(CH2OH—CHOH—CH2OH)分子中含有1个手性碳原子B.互为手性异构体的化合物,所含化学键的种类和数目完全相同C.互为手性异构体的化合物,在三维空间不能重合,但物理、化学性质却几乎完全相同D.互为手性异构体的化合物,分子组成不同,所以物理、化学性质也不同
解析 CH2OH—CHOH—CH2OH分子中不存在手性碳原子,故A错误;手性异构体为具有完全相同的组成和原子排列的一对分子,所含化学键的种类和数目完全相同,故B正确;互为手性异构体的化合物,物理性质不同,光学活性不同,故C错误;互为手性异构体的化合物,分子组成相同,故D 错误。
题组三 无机含氧酸的酸性5.判断含氧酸酸性强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示: 含氧酸酸性强弱与非羟基氧原子数的关系
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为①________________,②________________。(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①______________________________________________________________,②______________________________________________________________。(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况:______________,写出化学方程式:__________________________________________________。
分子(或离子)中大π键的判断方法
【核心归纳】 (1)大π键的含义 在一个平面形的多原子分子中,如果相邻原子有垂直于分子平面的、对称性一致的,未参与杂化轨道的原子轨道,那么这些轨道可以相互重叠,形成多中心π键。这种多中心π键又称为“共轭π键”或“离域π键”,简称“大π键”。
【典例】 (2017·全国卷Ⅱ)经X射线衍射测得化合物R[(N5)6(H3O)3(NH4)4Cl,五氮阴离子盐]的晶体结构,其局部结构如图所示。
【模型构建】 大π键中电子数的确定方法
1.(2021·山东卷)关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( ) A.CH3OH为极性分子 B.N2H4空间结构为平面形 C.N2H4的沸点高于(CH3)2NNH2 D.CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同
A.N的电负性比P的大,可推断NCl3分子的极性比PCl3的大B.N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高C.NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大D.HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低
2.(2021·湖北卷)下列有关N、P及其化合物的说法错误的是( )
解析 P和Cl的电负性差值比N和Cl的电负性差值大,因此PCl3分子的极性比NCl3分子的极性大,A项错误;N与N的π键比P与P的强,故N≡N的稳定性比P≡P的高,B项正确;N的电负性比P大,NH3中成键电子对距离N比PH3中成键电子对距离P近,NH3中成键电子对间的斥力大,因此NH3的键角比PH3的大,C项正确;相对分子质量:HNO3
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为________(填标号)。(2)CO2分子中存在________个σ键和________个π键。(3)甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是_________________________________________________________。答案 (1)sp3 ② (2)2 2 (3) 甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
4.(2021·全国乙卷)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题: (1)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是________,中心离子的配位数为________。 (2)[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
PH3中P的杂化类型是________。NH3的沸点比PH3的________,原因是_________________,H2O的键角小于NH3的,分析原因____________________________________________________________________________________。答案 (1)N、O、Cl 6 (2)sp3 高 NH3存在分子间氢键 NH3含有一对孤对电子,而H2O含有两对孤对电子,H2O中的孤对电子对成键电子对的排斥作用较大
解析 (1)[Cr(NH3)3(H2O)2Cl]2+中三价铬离子提供空轨道,N、O、Cl提供孤对电子与三价铬离子形成配位键,中心离子的配位数为N、O、Cl三种原子的个数和即3+2+1=6;(2)PH3的价层电子对为3+1=4,故PH3中P的杂化类型是sp3; N原子电负性较强,NH3分子之间存在分子间氢键,因此NH3的沸点比PH3的高;H2O的键角小于NH3的,原因是:NH3含有一对孤对电子,而H2O含有两对孤对电子,H2O中的孤对电子对成键电子对的排斥作用较大。
1.下列关于丙烯(CH3CH===CH2)的说法错误的是( ) A.丙烯分子中有8个σ键,1个π键 B.丙烯分子中3个碳原子都是sp3杂化 C.丙烯分子中存在非极性键 D.丙烯分子中3个碳原子在同一平面上
3.向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是( ) A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+ C.配位化合物中只有配位键 D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道 解析 NH3与Cu2+形成配位键,Cu2+提供空轨道,NH3提供孤电子对。
4.(2021·山东日照模拟)已知N—N、N===N和N≡N键能之比为1.00∶2.17∶4.90, 而C—C、C===C、C≡C键能之比为1.00∶1.77∶2.34。下列说法正确的是 ( ) A.σ键一定比π键稳定 B.N2较易发生加成反应 C.乙烯、乙炔易发生加成反应 D.乙烯、乙炔中的π键比σ键稳定 解析 N===N中有一个σ键,一个π键,其键能比为1.00∶2.17,说明在N===N中,π键比σ键稳定,故A错误,且N2不易发生加成反应(π键不易断开),B错误;而C===C、C≡C中的π键比σ键的键能小,易断开,故乙烯、乙炔易发生加成反应,C正确,D错误。
6.(2021·甘肃兰州模拟)下列分子所含原子中既有sp3杂化、又有sp2杂化的是 ( )
解析 乙醛中甲基中的碳原子采取sp3杂化,醛基中的碳原子采取sp2杂化;丙烯腈中双键连接的两个碳原子采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基中的碳原子采取sp3杂化,三键连接的两个碳原子采取sp杂化。
8.如图为酞菁钴分子的结构简式。下列说法不正确的是( )
A.电负性:N>C>HB.4个N原子均与C形成配位键C.分子中C的杂化轨道类型为sp2D.结构中存在σ键、π键和大π键
解析 电负性:N>C>H,A正确;从结构简式中可以看出,含有双键的N原子,其所含有的孤电子对与C形成配位键,4个N原子有2个与C形成配位键,有2个与C形成共价键,B不正确;分子中每个C的杂化轨道类型均为sp2,C正确;分子结构中成键原子间都存在σ键、部分N原子与C原子间形成π键,苯环中碳原子间形成大π键,D正确。
9.(2022·湖北武汉部分学校质检)下列有关物质结构与性质的因果关系论述错误的是( )
A.因为键能O—H>S—H,所以H2O的热稳定性强于H2SB.因为H2O的孤电子对数多于SO3,所以H2O的键角小于SO3C.因为HClO4的非羟基氧数目多于HClO,所以HClO4酸性强于HClOD.因为Cs+半径大于Na+,所以CsCl中阳离子的配位数比NaCl中的大
解析 气态氢化物的热稳定性与该非金属元素与氢形成的化学键键能有关,键能越大,气态氢化物越稳定,A项正确;H2O的中心O原子形成2个σ键,有2个孤电子对,采用sp3杂化,水分子的空间构型是V形,SO3的中心S原子形成3个σ键,无孤电子对,采用sp2杂化,三氧化硫的空间构型为平面三角形,所以H2O的键角小于SO3,B项错误;含氧酸分子结构中非羟基氧原子数越多,该含氧酸的酸性越强,高氯酸中有3个非羟基氧,次氯酸中没有非羟基氧,故酸性:高氯酸>次氯酸,C项正确;正负离子的半径比决定正负离子的配位数,比值越大配位数越多,Cs+半径大于Na+,故阴离子相同时,配位数:Cs+>Na+,D项正确。
10.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是( ) A.配体是Cl-和H2O,配位数是9 B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ C.内界和外界中Cl-的数目比是1∶2 D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 解析 [TiCl(H2O)5]Cl2·H2O,配体是Cl-、H2O,提供孤电子对;中心离子是Ti3+,配合物中配位离子Cl-不与Ag+反应,外界中的Cl-与Ag+反应。
11.(2021·山东潍坊模拟)(1)向盛有CuSO4水溶液的试管里加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色的透明溶液,加入乙醇时,析出深蓝色的晶体。 则:①“首先形成蓝色沉淀”对应的离子方程式为________________。 ②实验过程中出现的“深蓝色的透明溶液”和“深蓝色的晶体”都是因为存在配离子________(填离子符号)。该配离子中存在的化学键有________________;其配体的中心原子的杂化类型为________。 (2)Cu2+可形成多种配合物,与Cu2+形成配合物的分子或离子应具备的结构特征是________。
(3)已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_________________________________________________________。
解析 (1)硫酸铜溶液中加入氨水,先发生复分解反应,生成硫酸铵和氢氧化铜沉淀,然后过量的氨水和氢氧化铜反应生成四氨合铜配离子,配离子中氨和铜之间是配位键,氨中氮和氢原子间是极性共价键;配体氨中氮原子为sp3杂化。(3)NF3与NH3的差别在于前者氮元素呈+3价,后者氮元素呈-3价,分子中共用电子对偏向不同,因此NH3作配体能力比NF3强得多,NF3不易与Cu2+形成配离子。
12.按要求回答下列问题。
(6)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图所示。化合物乙的沸点明显高于化合物甲,主要原因是___________________________。
解析 同周期主族元素从左至右第一电离能呈增大趋势,电负性逐渐增大,所以电负性和第一电离能O>C,A项正确;CO与N2互为等电子体,根据N2的分子结构,可知CO分子的结构式为C≡O,1个CO分子中含有1个σ键和2个π键,B项正确;根据C3O2的结构可推出C3O2分子的空间构型应为直线形,C原子为sp杂化,C项正确;C3O2分子的空间构型为直线形,结构对称,正负电荷中心重合,为非极性分子,D项错误。
14.(2022·湖北武汉部分学校质检)某重金属解毒剂的分子结构如图所示,其中W、X、Y、Z均为短周期元素,且W、X、Y的质子数之和比Z的小1。下列说法错误的是( )
A.电负性:Y>Z>X>WB.该解毒剂的沸点比丙三醇的低C.分子结构中X、Y、Z杂化类型相同D.重金属提供孤电子对与该解毒剂形成配位键
15.1985年,Russsin研究发现了第一个金属原子簇类配位化合物,其结构如图所示,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。请回答下列问题:
(3)上述原子簇类配合物,中心原子铁的配位原子是________。(4)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃。可用于制备纯铁。Fe(CO)5的结构如图所示。下列关于Fe(CO)5说法正确的是________(填字母)。
A.Fe(CO)5是非极性分子,CO是极性分子B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键C.1 ml Fe(CO)5含有10 ml配位键D.Fe(CO)5===Fe+5CO反应中没有新化学键生成
答案 (1)N>O>S 三角锥形 (2)sp (3)S、N (4)AC
2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考): 这是一份2023版 创新设计 高考总复习 化学 苏教版专题12 物质结构与性质(选考),文件包含2023版创新设计高考总复习化学苏教版第一单元原子结构与性质pptx、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质pptx、2023版创新设计高考总复习化学苏教版第二单元分子结构与性质DOCX、2023版创新设计高考总复习化学苏教版第三单元晶体结构与性质DOCX、2023版创新设计高考总复习化学苏教版第一单元原子结构与性质DOCX等6份课件配套教学资源,其中PPT共180页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 人教版第十一章 有机化学基础(选考): 这是一份2023版 创新设计 高考总复习 化学 人教版第十一章 有机化学基础(选考),文件包含2023版创新设计高考总复习化学人教版最新版第1讲认识有机化合物pptx、2023版创新设计高考总复习化学人教版最新版第2讲烃和卤代烃pptx、2023版创新设计高考总复习化学人教版最新版第3讲烃的含氧衍生物pptx、2023版创新设计高考总复习化学人教版最新版第4讲基本营养物质有机高分子化合物pptx、2023版创新设计高考总复习化学人教版最新版第4讲基本营养物质有机高分子化合物doc、2023版创新设计高考总复习化学人教版最新版第1讲认识有机化合物doc、2023版创新设计高考总复习化学人教版最新版第3讲烃的含氧衍生物doc、2023版创新设计高考总复习化学人教版最新版第2讲烃和卤代烃doc、2023版创新设计高考总复习化学人教版最新版本章常考必备的重要有机转化关系及反应方程式书写强化练pptx、2023版创新设计高考总复习化学人教版最新版本章常考必备的重要有机转化关系及反应方程式书写强化练doc等10份课件配套教学资源,其中PPT共252页, 欢迎下载使用。
2023版 创新设计 高考总复习 化学 鲁科版第12章 物质结构与性质(选考): 这是一份2023版 创新设计 高考总复习 化学 鲁科版第12章 物质结构与性质(选考),文件包含2023版创新设计高考总复习化学鲁科版第1讲原子结构pptx、2023版创新设计高考总复习化学鲁科版第2讲化学键与分子间作用力pptx、2023版创新设计高考总复习化学鲁科版第3讲物质的聚集状态与物质性质pptx、2023版创新设计高考总复习化学鲁科版第2讲化学键与分子间作用力DOCX、2023版创新设计高考总复习化学鲁科版第3讲物质的聚集状态与物质性质DOCX、2023版创新设计高考总复习化学鲁科版第1讲原子结构DOCX等6份课件配套教学资源,其中PPT共180页, 欢迎下载使用。












