




8.4难溶电解质的溶解平衡
展开考 纲要 求1.了解难溶电解质的沉淀溶解平衡。2.理解溶度积的含义,能进行相关的计算。3.了解沉淀溶解平衡的应用。
考点一 沉淀溶解平衡及应用
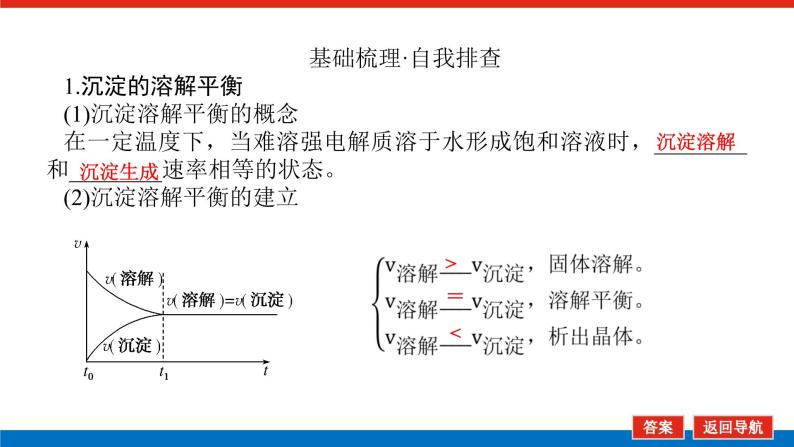
基础梳理·自我排查1.沉淀的溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,________和________速率相等的状态。(2)沉淀溶解平衡的建立
(3)沉淀溶解平衡的影响因素
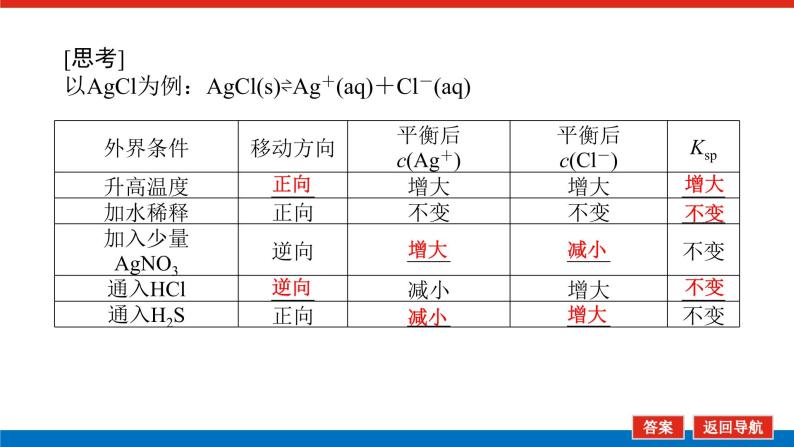
[思考]以AgCl为例:AgCl(s)⇌Ag+(aq)+Cl-(aq)
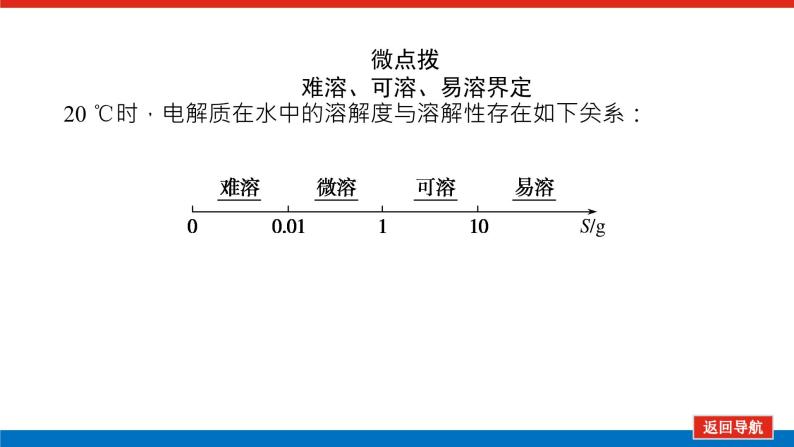
微点拨 难溶、可溶、易溶界定20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
2.沉淀溶解平衡的应用(1)沉淀的生成①调节pH法如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至3~4,离子方程式为_________________________________。②沉淀剂法。如用H2S沉淀Cu2+,离子方程式为________________________。
H2S+Cu2+===CuS↓+2H+
(2)沉淀的溶解①酸溶解法如CaCO3溶于盐酸,离子方程式为____________________________。②盐溶液溶解法如Mg(OH)2溶于NH4Cl溶液,离子方程式为_______________________________。③氧化还原溶解法如不溶于盐酸的硫化物Ag2S溶于稀HNO3。④配位溶解法如AgCl溶于氨水,离子方程式为________________________________________。
CaCO3+2H+===Ca2++H2O+CO2↑
AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O
Cu2++ZnS(s)⇌Zn2++CuS(s)
微点拨1.AgCl(s)⇌Ag+(aq)+Cl-(aq)与AgCl===Ag++Cl-所表示的意义不同。前者表示难溶电解质AgCl在水溶液中的沉淀溶解平衡方程式,后者表示强电解质AgCl在水溶液中的电离方程式。2.用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 ml·L-1时,沉淀已经完全。
考点专练·层级突破练点一 沉淀溶解平衡的分析1.实验:①0.1 ml·L-1 AgNO3溶液和0.1 ml·L-1 NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1 ml·L-1 KI溶液,出现浑浊;③向沉淀c中滴加0.1 ml·L-1 KI溶液,沉淀变为黄色。下列分析不正确的是( )A.浊液a中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl-(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶
解析:在浊液a中,存在AgCl的沉淀溶解平衡,即在滤液b中,仍含有少量Ag+,故在b中生成了AgI沉淀,A正确,B错误;向白色沉淀AgCl中滴加KI溶液生成黄色AgI,由此可说明AgI比AgCl更难溶,C项和D项都正确。
练点二 沉淀溶解平衡的应用3.下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是( )①热纯碱溶液洗涤油污的能力比冷纯碱溶液强②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒 ③石灰岩(喀斯特地貌)溶洞的形成 ④BaCO3不能作“钡餐”,而BaSO4可以 ⑤泡沫灭火器灭火原理A.②③④ B.①②③C.③④⑤ D.①②③④⑤
解析:①碳酸钠是强碱弱酸盐,因为水解使其溶液呈碱性,加热促进水解,碱能促进油脂水解,所以热纯碱溶液洗涤油污的能力更强,应用了盐类水解原理,不符合题意;②钡离子有毒,所以可溶性的钡盐有毒,钡离子和硫酸根离子反应生成不溶于酸和水的硫酸钡,即易溶性的物质向难溶性的物质转化,所以可以用沉淀溶解平衡原理来解释;③石灰岩里不溶性的碳酸钙在水和二氧化碳的作用下转化为微溶性的碳酸氢钙,长时间反应,形成溶洞,可以用沉淀溶解平衡原理来解释;④碳酸钡能和盐酸反应生成氯化钡、二氧化碳和水,硫酸钡和盐酸不反应,所以碳酸钡不能作“钡餐”而硫酸钡可以,可以用沉淀溶解平衡原理来解释;⑤碳酸氢钠水解使其溶液呈碱性,硫酸铝水解使其溶液呈酸性,氢离子和氢氧根离子反应生成水,则碳酸氢钠和硫酸铝相互促进水解,从而迅速产生二氧化碳,所以可以用盐类水解原理来解释泡沫灭火器灭火的原理,不符合题意。
解析:根据一般情况下沉淀转化向溶度积小的方向进行可知,Ksp(MnS)>Ksp(CuS),A项正确;该反应达平衡时c(Mn2+)、c(Cu2+)保持不变,但不一定相等,B项错误;往平衡体系中加入少量CuSO4固体后,平衡向正反应方向移动,c(Mn2+)变大,C项正确;该反应的平衡常数K=
5.要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:由上述数据可知,沉淀剂最好选用( )A.硫化物 B.硫酸盐C.碳酸盐 D.以上沉淀剂均可
解析:沉淀工业废水中的Pb2+时,生成沉淀的反应进行得越完全越好,由于PbS的溶解度最小,故选硫化物作为沉淀剂。
练后归纳沉淀生成的两大应用 (1)分离离子:同一类型的难溶电解质,如AgCl、AgBr、AgI,溶度积小的物质先析出,溶度积大的物质后析出。(2)控制溶液的pH来分离物质,如除去CuCl2中的FeCl3就可向溶液中加入CuO或Cu(OH)2等物质,将Fe3+转化为Fe(OH)3而除去。
基础梳理·自我排查1.溶度积和离子积以AmBn(s)⇌mAn+(aq)+nBm-(aq)为例:
cm(An+)·cn(Bm-)
2.Ksp的影响因素(1)内因:难溶物质本身的性质。(2)外因:Ksp只受____影响与其它因素无关。
[判断] (正确的打“√”,错误的打“×”)(1)Ksp既与难溶电解质的性质和温度有关,也与沉淀的量和溶液中的离子浓度有关( )(2)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( )(3)常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )(4)溶度积常数Ksp只受温度影响,温度升高Ksp增大( )(5)常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变( )
微点拨 (1)复分解反应总是向着某些离子浓度减小的方向进行,若生成难溶电解质,则向着生成溶度积较小的难溶电解质的方向进行。(2)并非Ksp越小,其物质的溶解性就越小。对于阴、阳离子的个数比相同的难溶电解质,它们的溶解性可以直接用Ksp的大小来比较;而对于阴、阳离子的个数比不同的难溶电解质,它们的溶解性就不能直接用Ksp的大小来比较。
考点专练·层级突破练点一 溶度积常数的计算与判断1.在溶液中有浓度均为0.01 ml·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cr(OH)3]=7.0×10-31,Ksp[Zn(OH)2]=1.0×10-17,Ksp[Mg(OH)2]=5.6×10-12。当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小( )A.Fe3+ B.Cr3+C.Zn2+ D.Mg2+
解析:根据题意,M(OH)n开始沉淀时,OH-的最小浓度为 ,代入数值,可以计算出四种离子浓度相同时,Fe3+开始沉淀时所需溶液中的c(OH-)最小,溶液的pH最小。
2.T ℃时,CaCO3和CaF2的Ksp分别为1.0×10-10和4.0×10-12。下列说法正确的是( )A.T ℃时,两饱和溶液中c(Ca2+):CaCO3 > CaF2B.T ℃时,两饱和溶液等体积混合,会析出CaF2固体C.T ℃时,CaCO3固体在稀盐酸中的Ksp比在纯水中的Ksp大D.T ℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体
4.已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T ℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点B.a点溶液若降低温度,则a点可沿虚线移动到c点C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动D.根据曲线数据计算可知,T ℃下,Ksp(Ag2SO4)=2.25×10-4
方法总结沉淀溶解平衡图像“三步”分析法1.第一步:明确图像中纵、横坐标的含义纵、横坐标通常是难溶物溶解后电离出的离子浓度。
2.第二步:理解图像中线上点、线外点的含义(1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外的点。 (2)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp。(3)曲线下方区域的点均为不饱和溶液,此时Qc
2.[2021·全国乙卷,13]HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K时c2(M+)~c(H+)为线性关系,如下图中实线所示。 下列叙述错误的是( )A.溶液pH = 4 时,c(M+)<3.0×10-4ml·L-1B.MA的溶度积Ksp(MA)=5.0×10-8C.溶液 pH = 7 时,c(M+)+c(H+)=c(A-)+c(OH-)D.HA的电离常数Ka(HA)≈2.0×10-4
3.[2019·全国卷Ⅱ,12]绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)
5.[全国卷Ⅲ]用0.100 ml·L-1 AgN O3滴定50.0 mL 0.050 0 ml·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( ) A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)C.相同实验条件下,若改为0.040 0 ml·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.050 0 ml·L-1 Br-,反应终点c向b方向移动
人教版高考化学一轮复习8.4难溶电解质的溶解平衡课件: 这是一份人教版高考化学一轮复习8.4难溶电解质的溶解平衡课件
2023届高考全国通用版化学一轮考点复习8.4难溶电解质的溶解平衡课件: 这是一份2023届高考全国通用版化学一轮考点复习8.4难溶电解质的溶解平衡课件,共55页。PPT课件主要包含了考点一,考点二,真题演练,沉淀溶解,沉淀生成,溶解的方向,生成沉淀的方向,沉淀溶解平衡,AgCl,AgBr等内容,欢迎下载使用。
难溶电解质的溶解平衡(复习梳理): 这是一份难溶电解质的溶解平衡(复习梳理),共12页。PPT课件主要包含了难溶电解质的溶解,平衡移动因素,沉淀溶解常数,∆H0,加水稀释,加相同离子,加反应离子,平衡逆移,平衡正移,表达式等内容,欢迎下载使用。












