














































2022年中考化学冲刺复习-推断题突破口专项练习
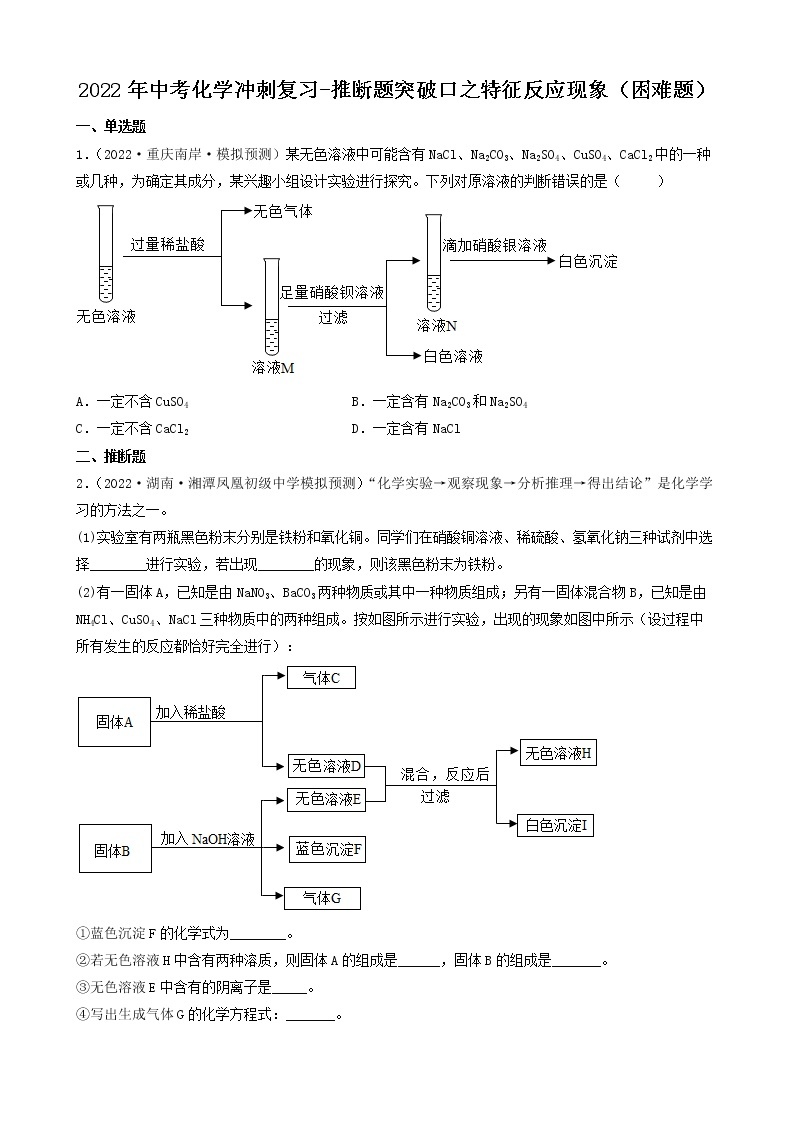
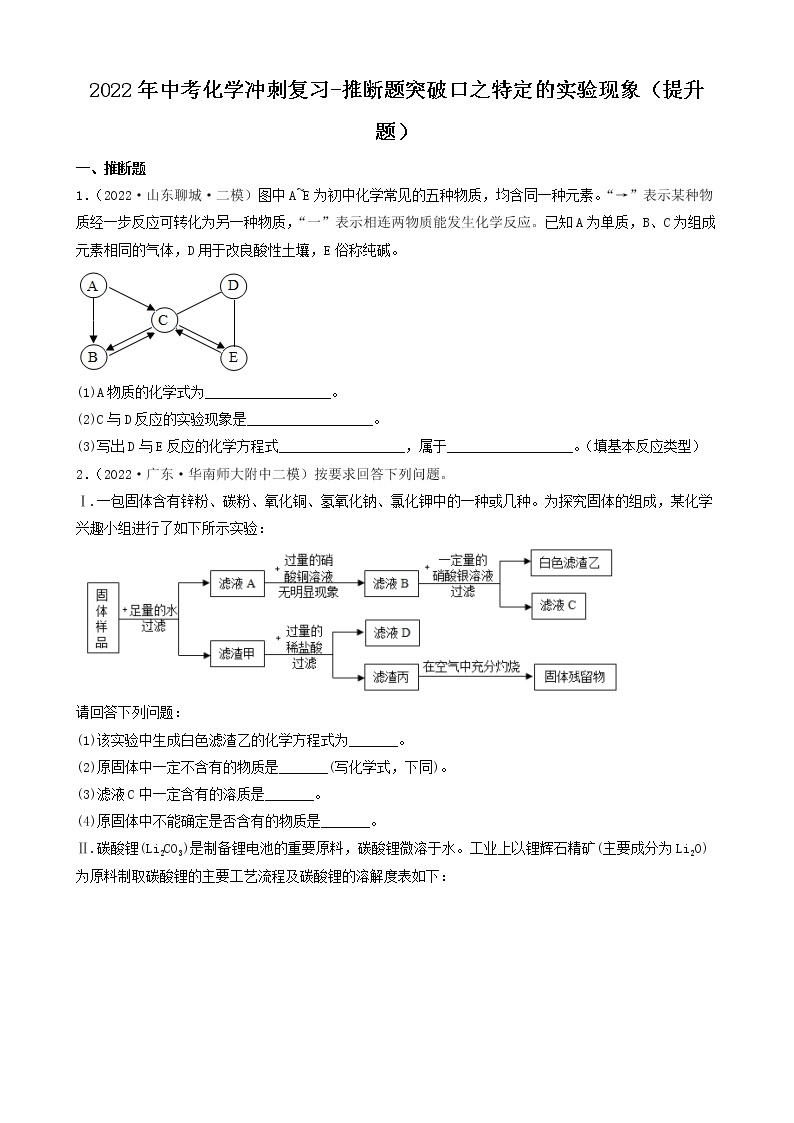
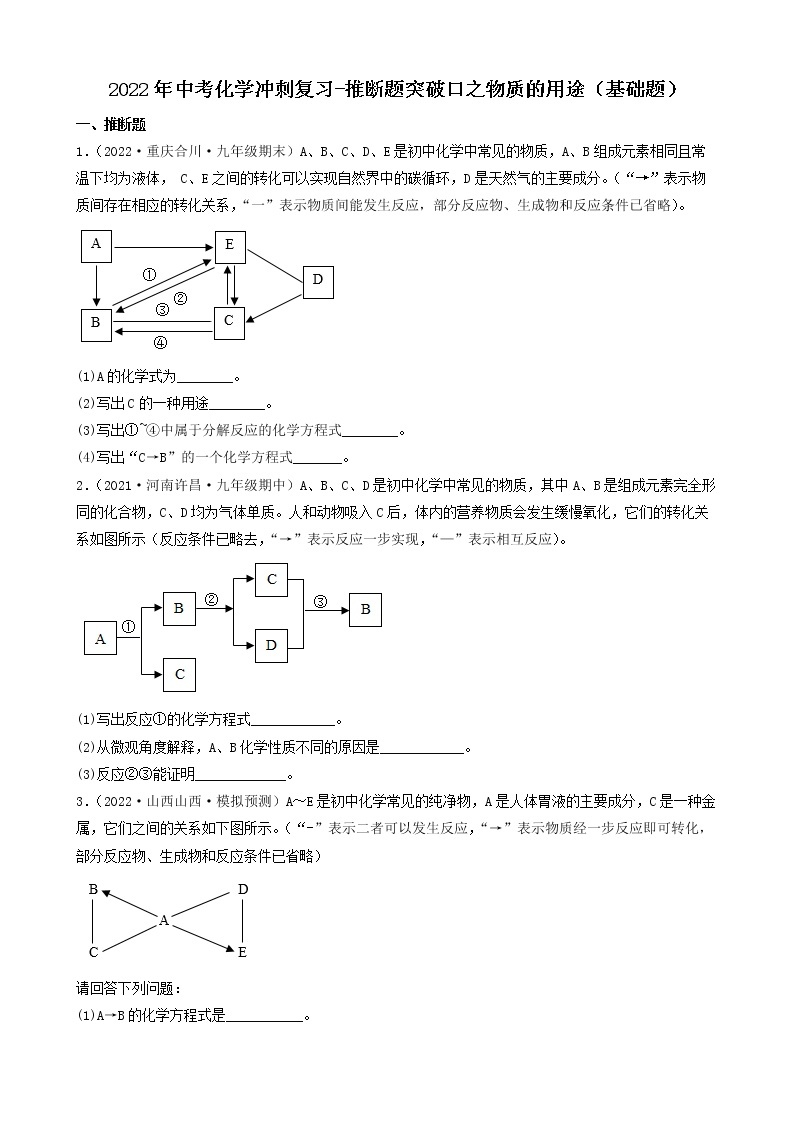
展开2022年中考化学冲刺复习-推断题突破口之颜色特征②
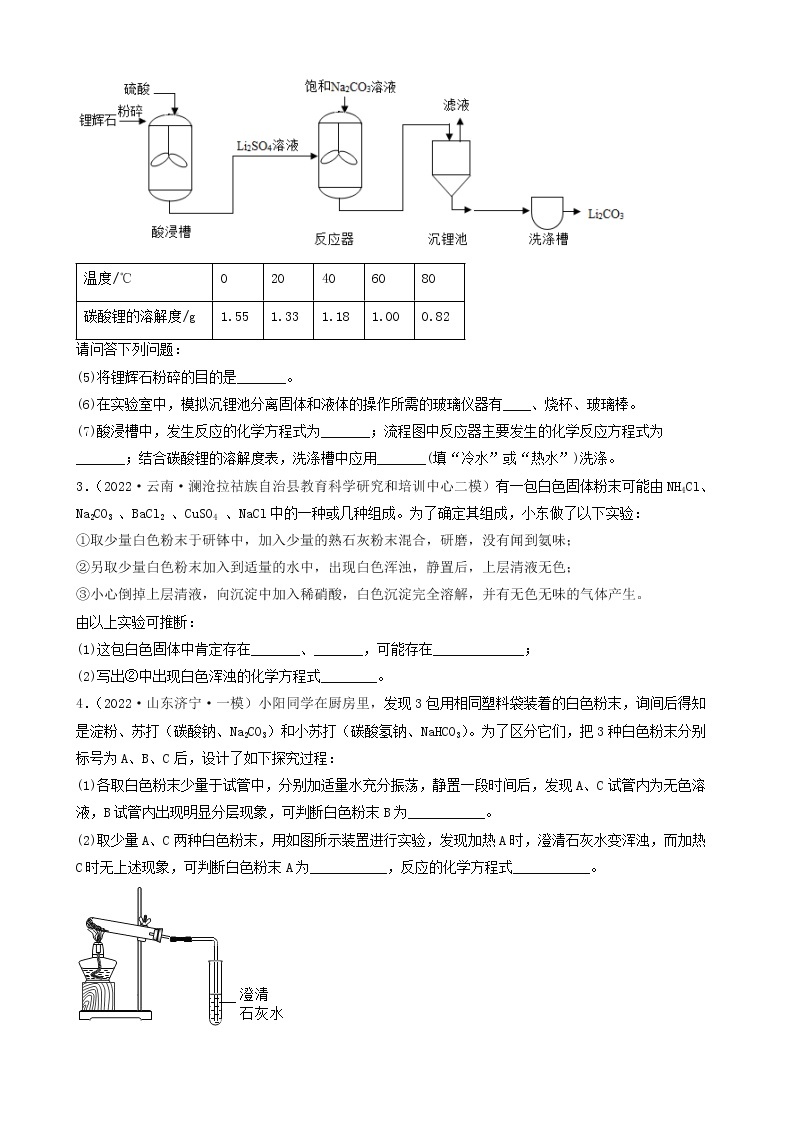
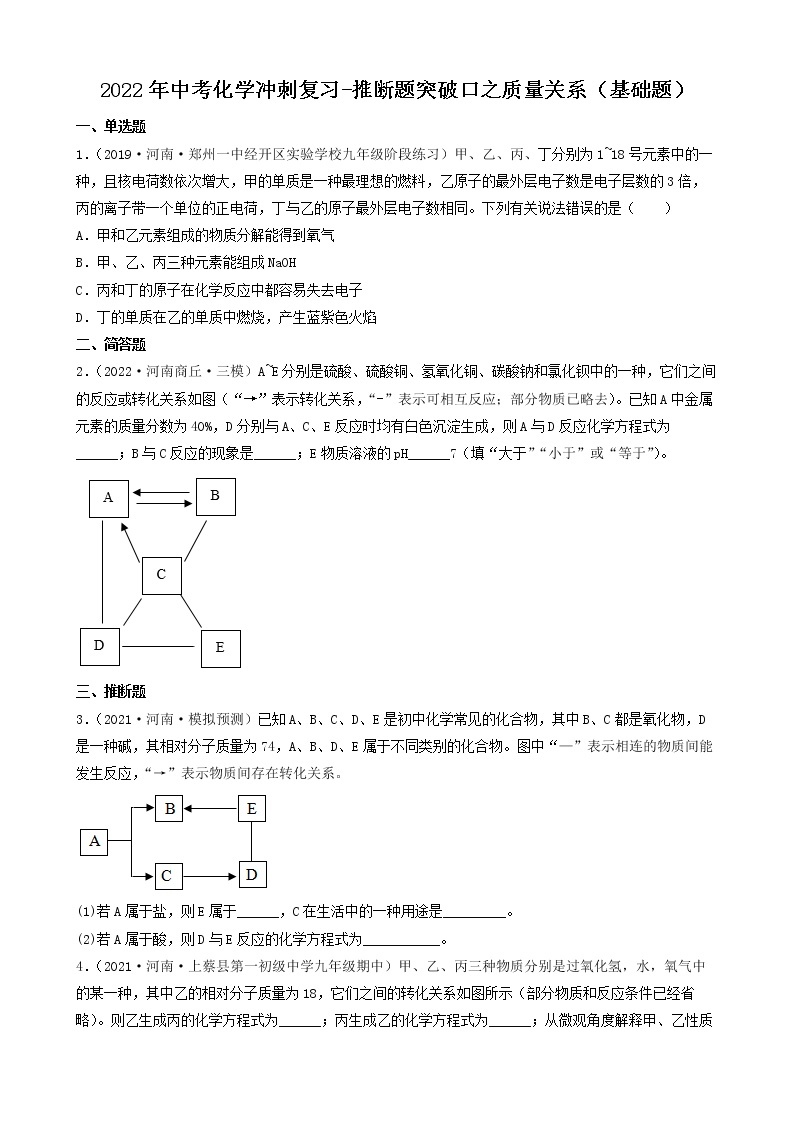
一、推断题
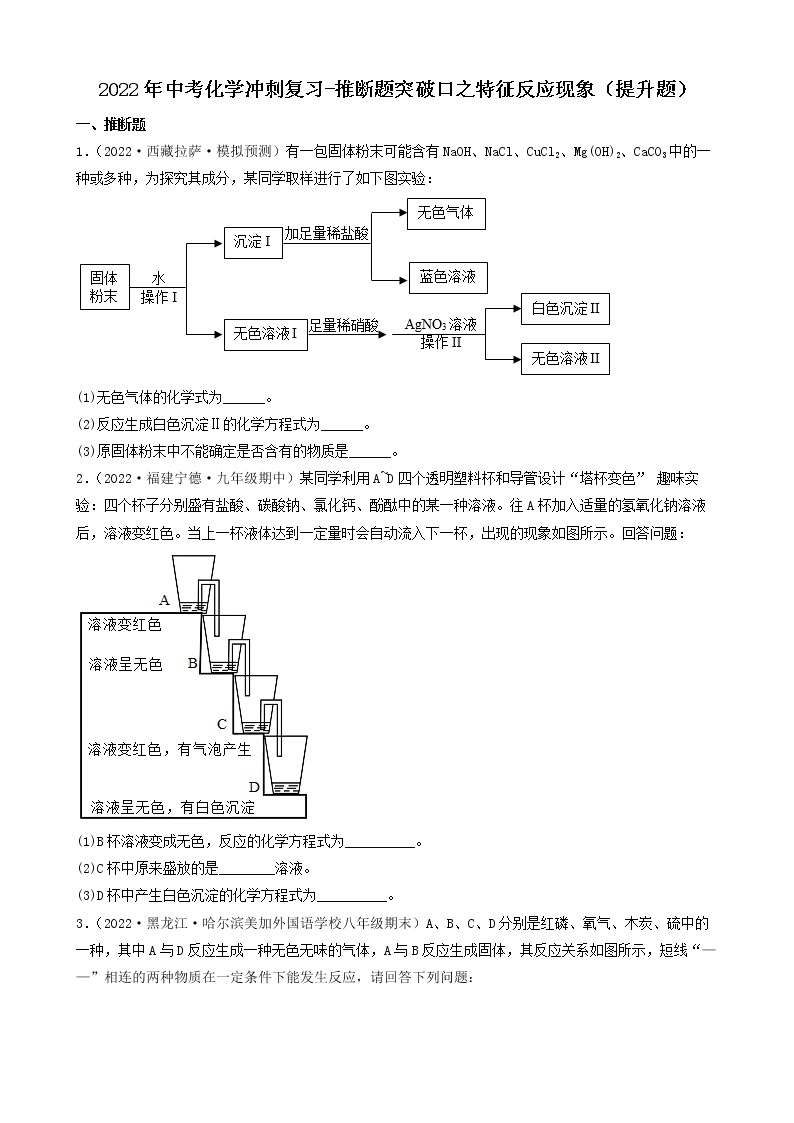
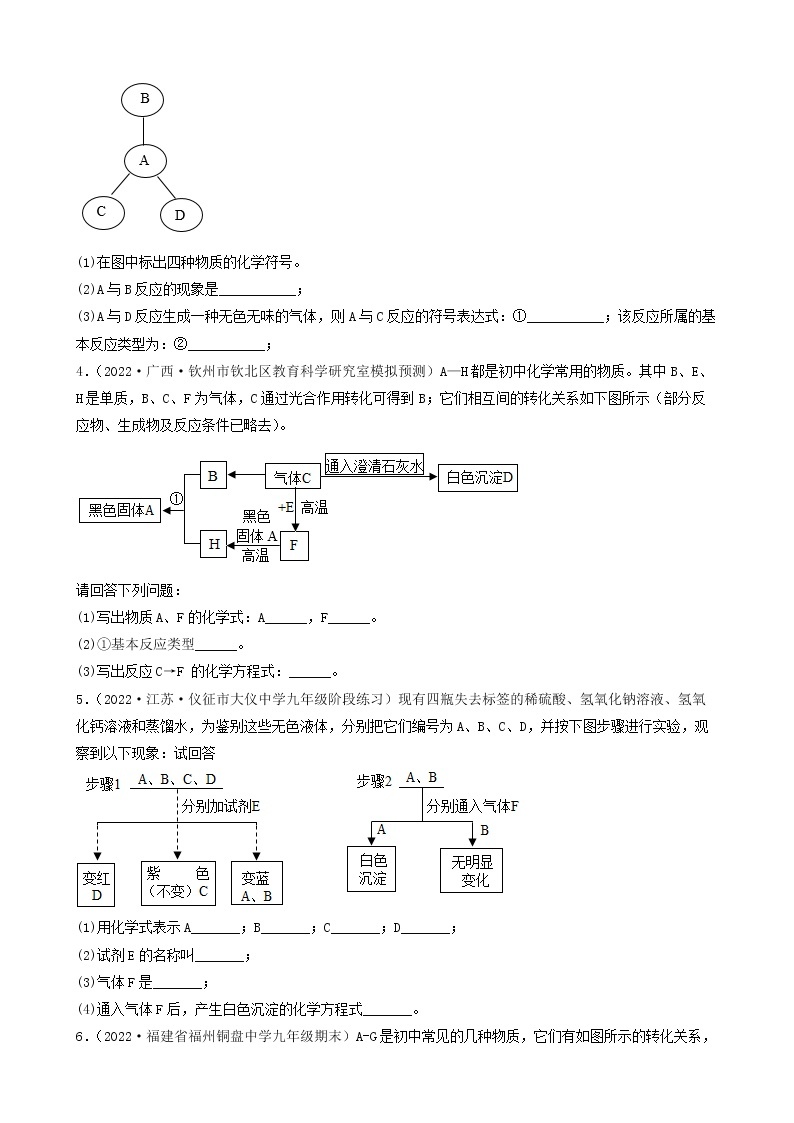
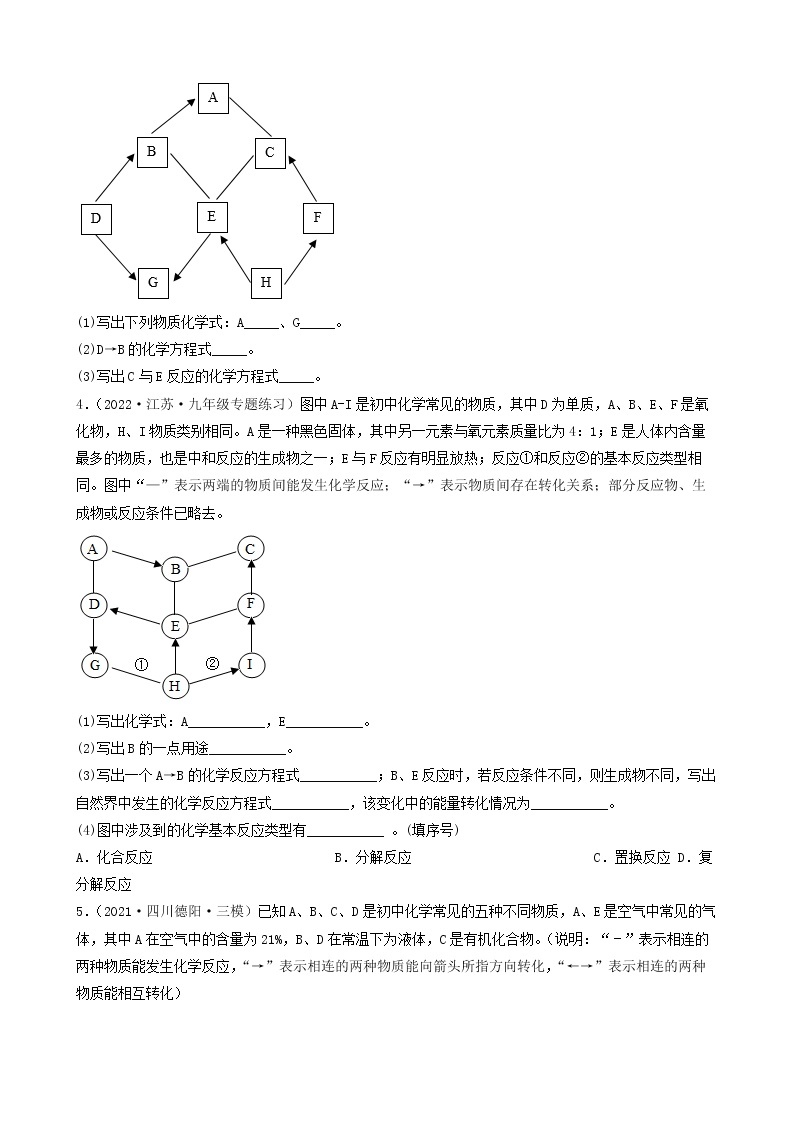
1.(2022·四川广元·一模)有一包白色粉末,可能由碳酸钙、硫酸铜、硝酸钡、氯化钾和氢氧化钠中的一种或几种组成,为确定其组成,进行如下实验:
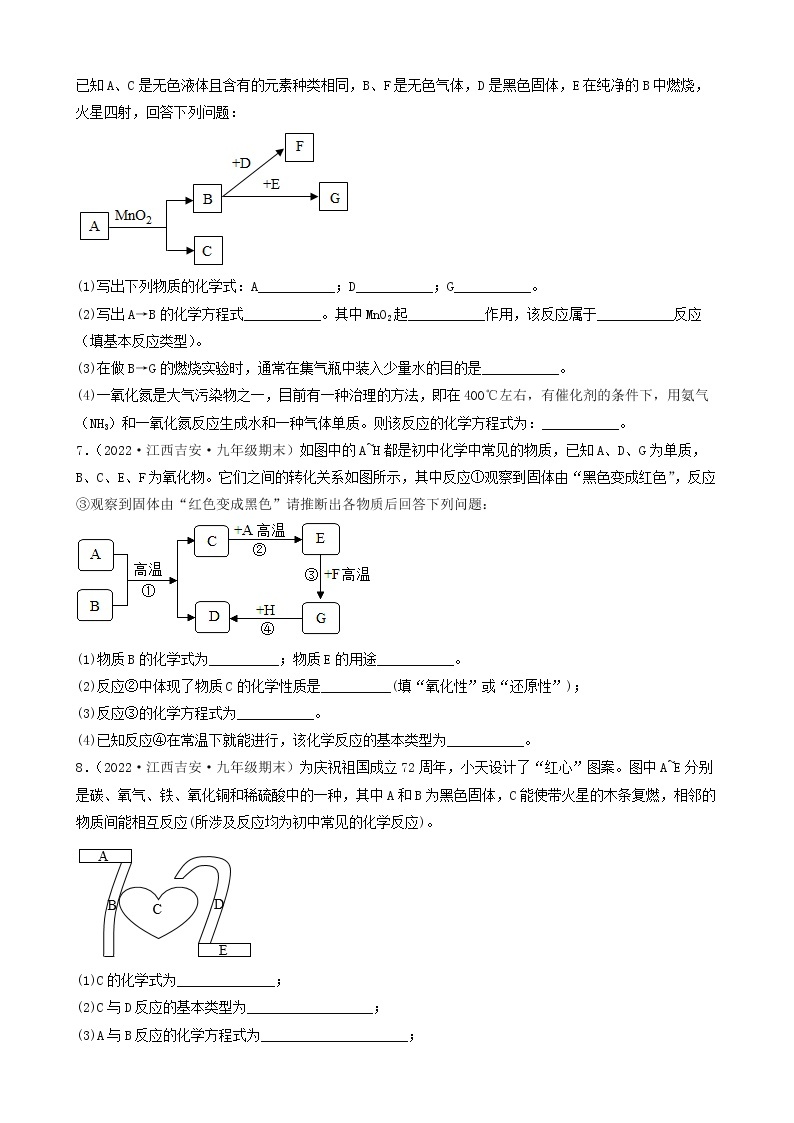
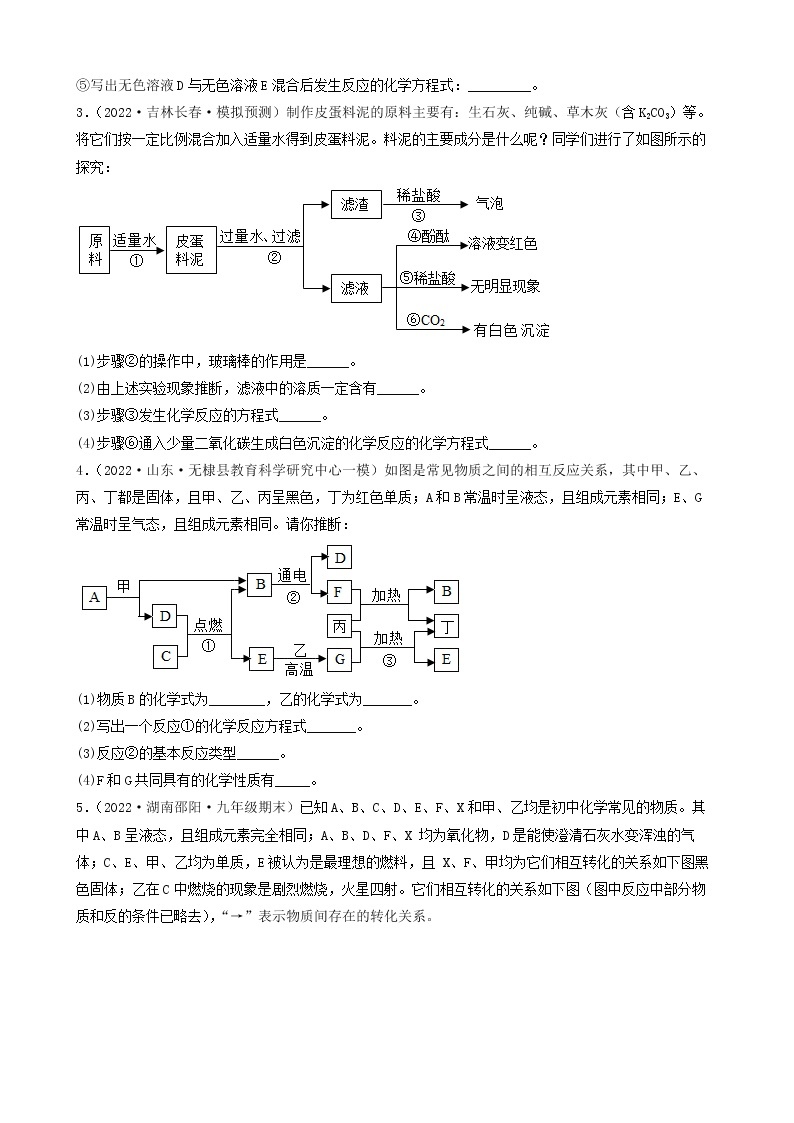
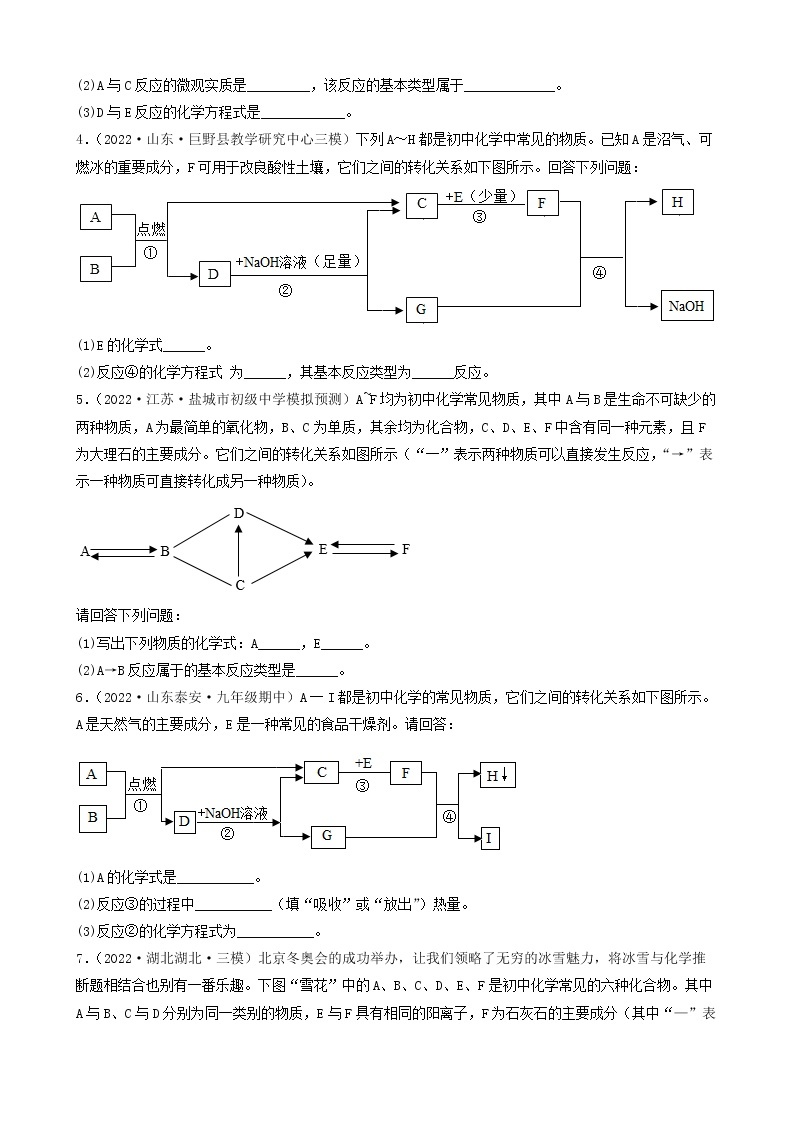
步骤一:取少量固体放入试管中加水充分溶解后,产生浑浊现象,过滤、得到白色沉淀和蓝色溶液;
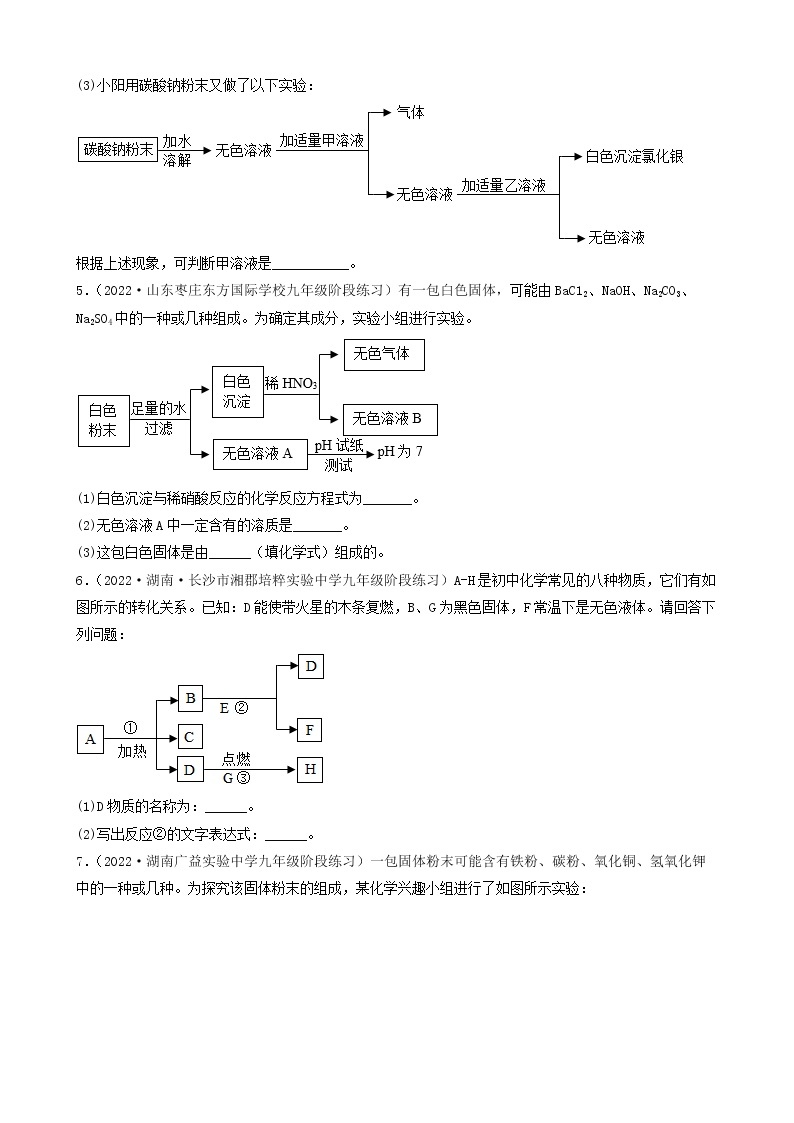
步骤二:取少量蓝色溶液,加入足量氯化钡溶液,无明显现象;
步骤三:取白色沉淀,加入足量的稀硝酸,沉淀部分溶解且产生气泡。
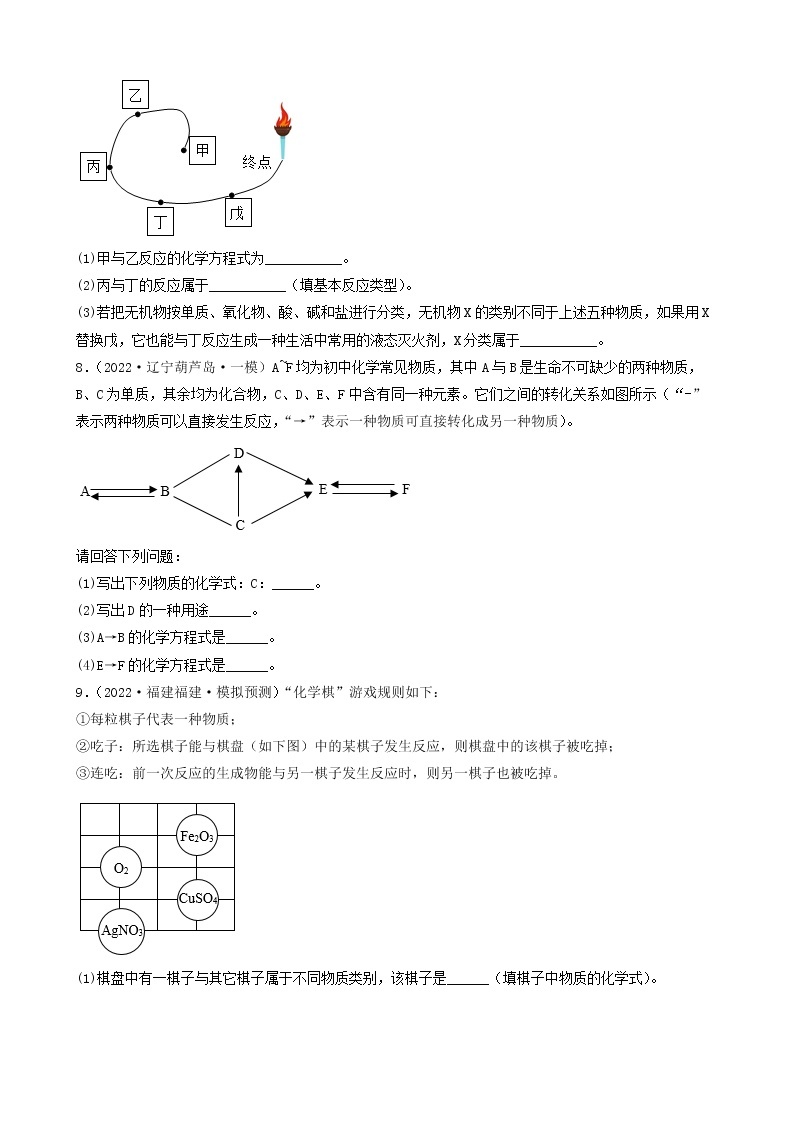
(1)步骤一中得到白色沉淀,其成分为________ (填化学式)。
(2)原白色粉末的成分中一定含有___________ (填化学式,后同),一定不含___________。
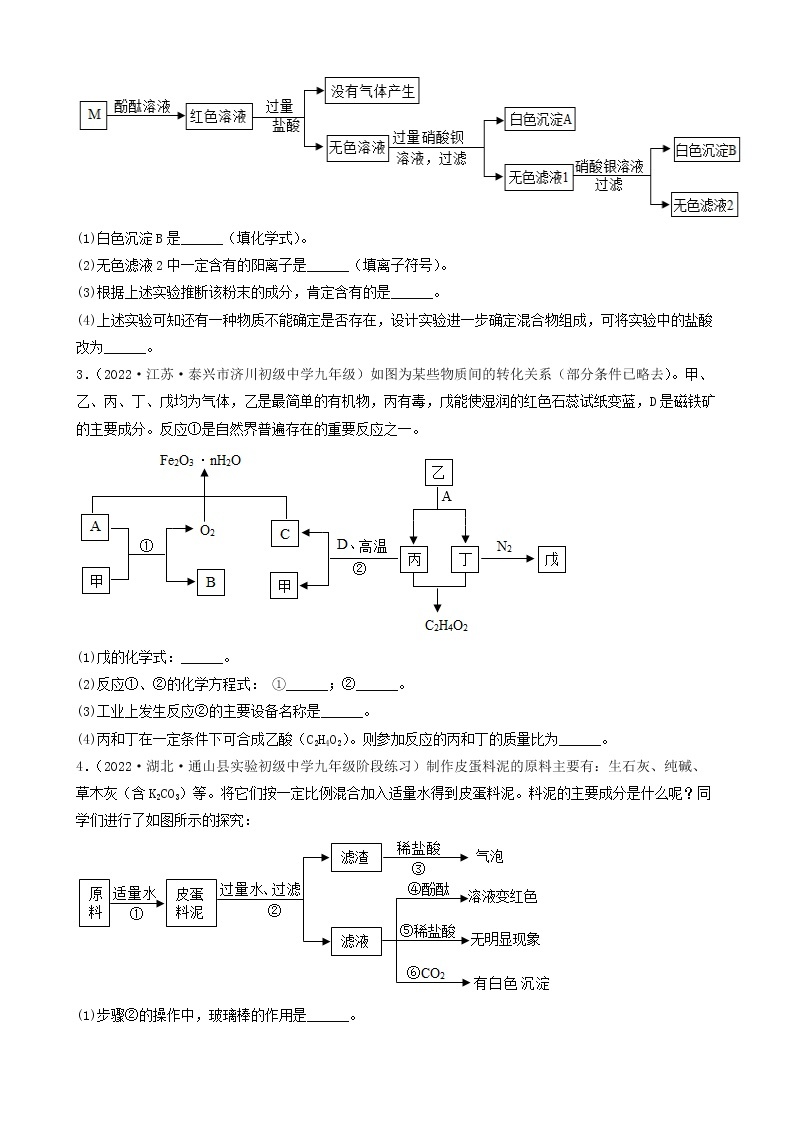
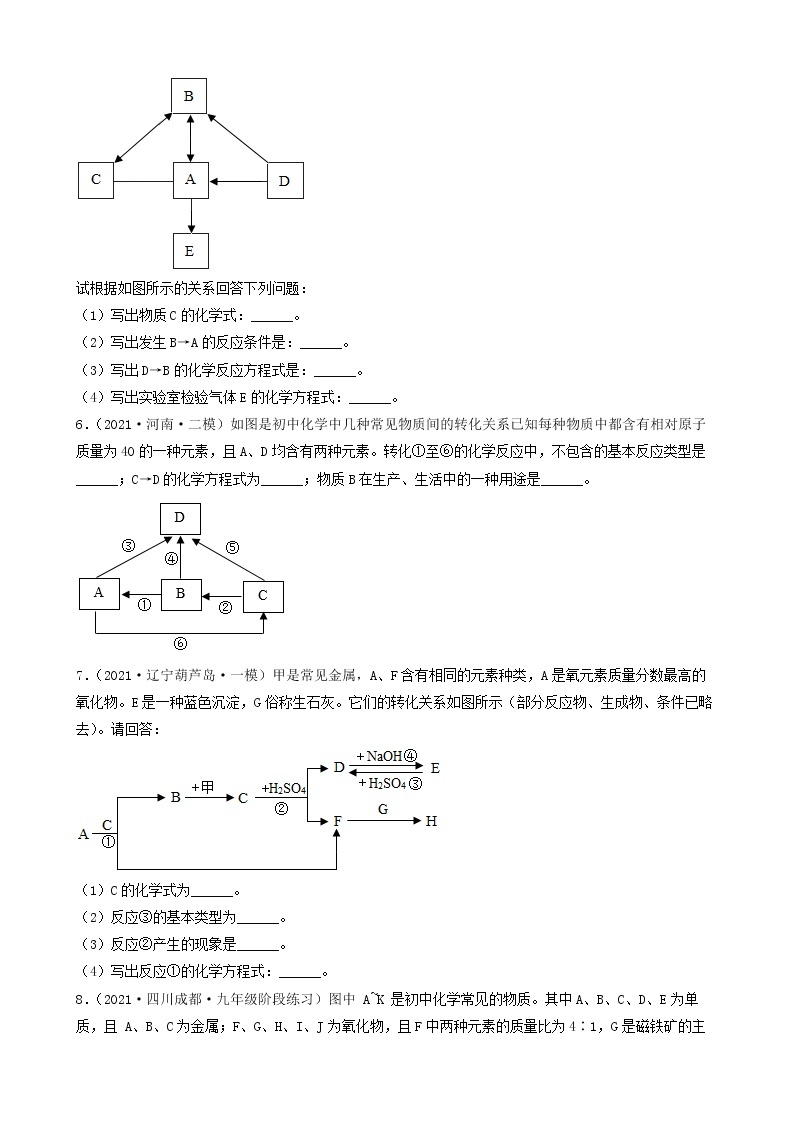
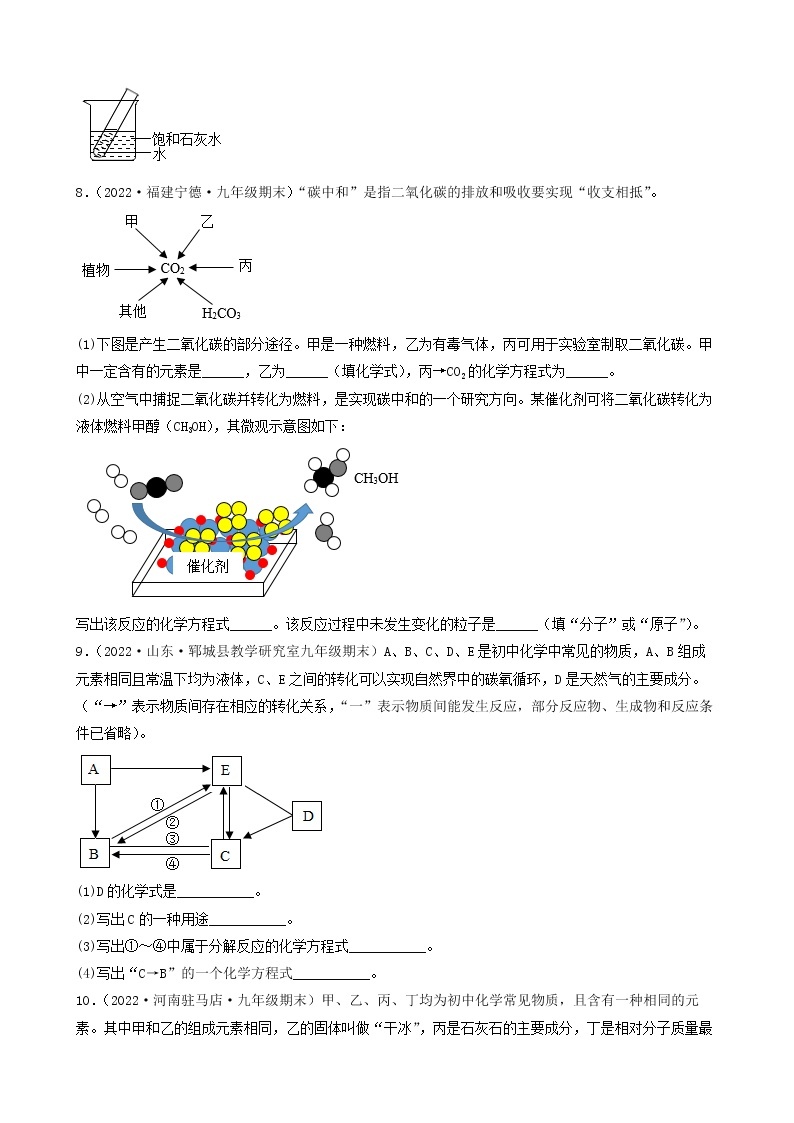
2.(2022·江苏镇江·一模)现有一包NaOH样品,可能含有Na2SO4、Na2CO3、BaCl2、CuSO4、NaCl中的一种或几种。为探究其成分,进行如下实验:
(1)由实验Ⅰ可知,样品中一定不含有_________。
(2)由实验Ⅲ可知,样品中一定含有_________,一定还不含有_________。
(3)根据实验Ⅳ得出样品中一定还含有_________。
(4)实验Ⅱ发生反应的化学方程式_________。
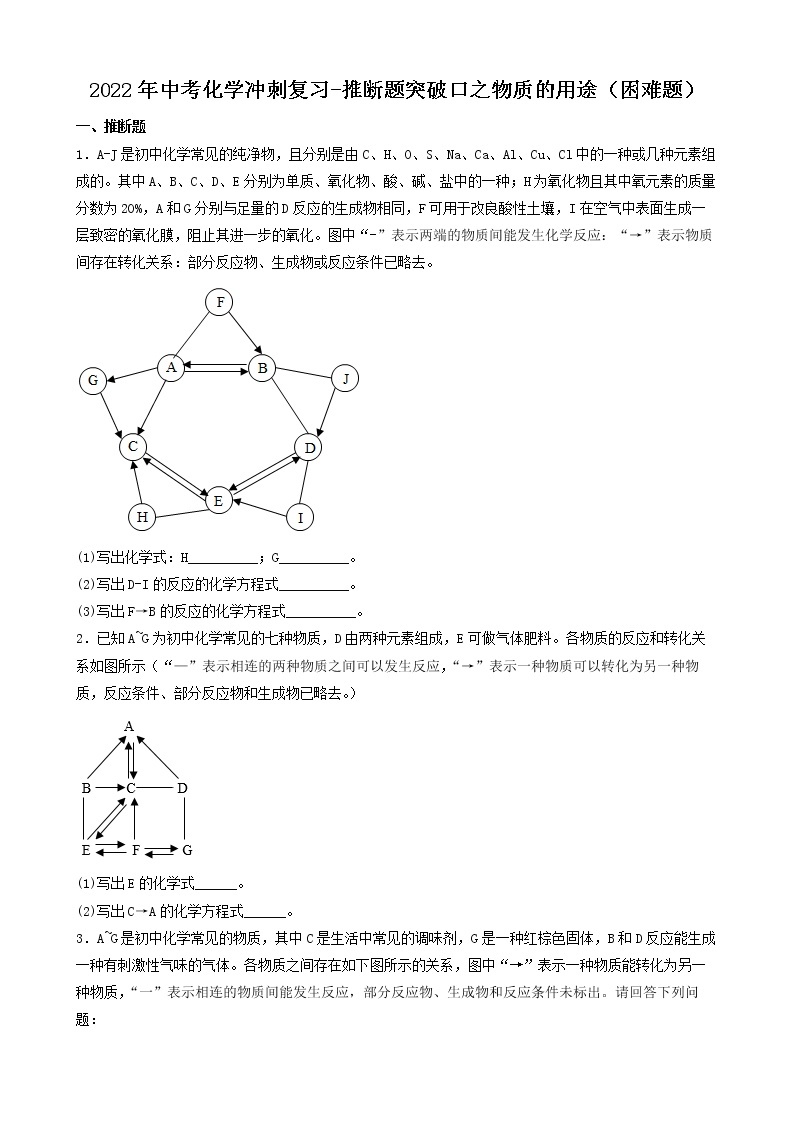
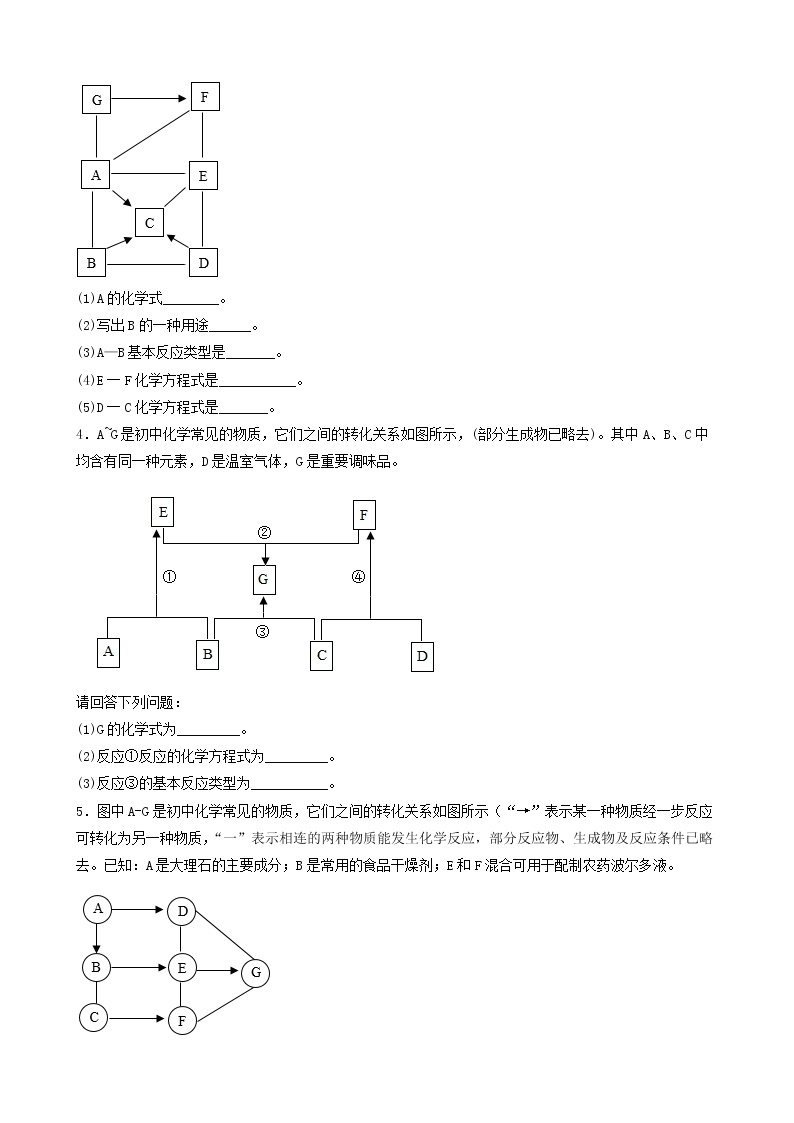
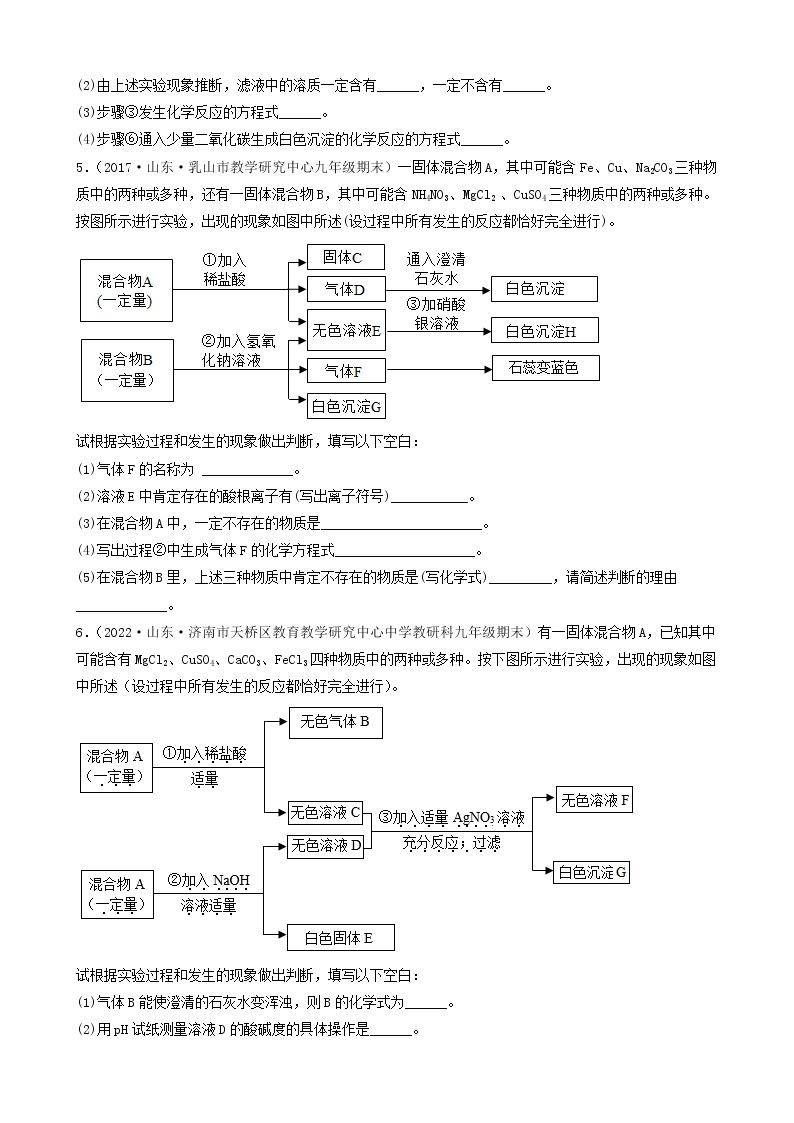
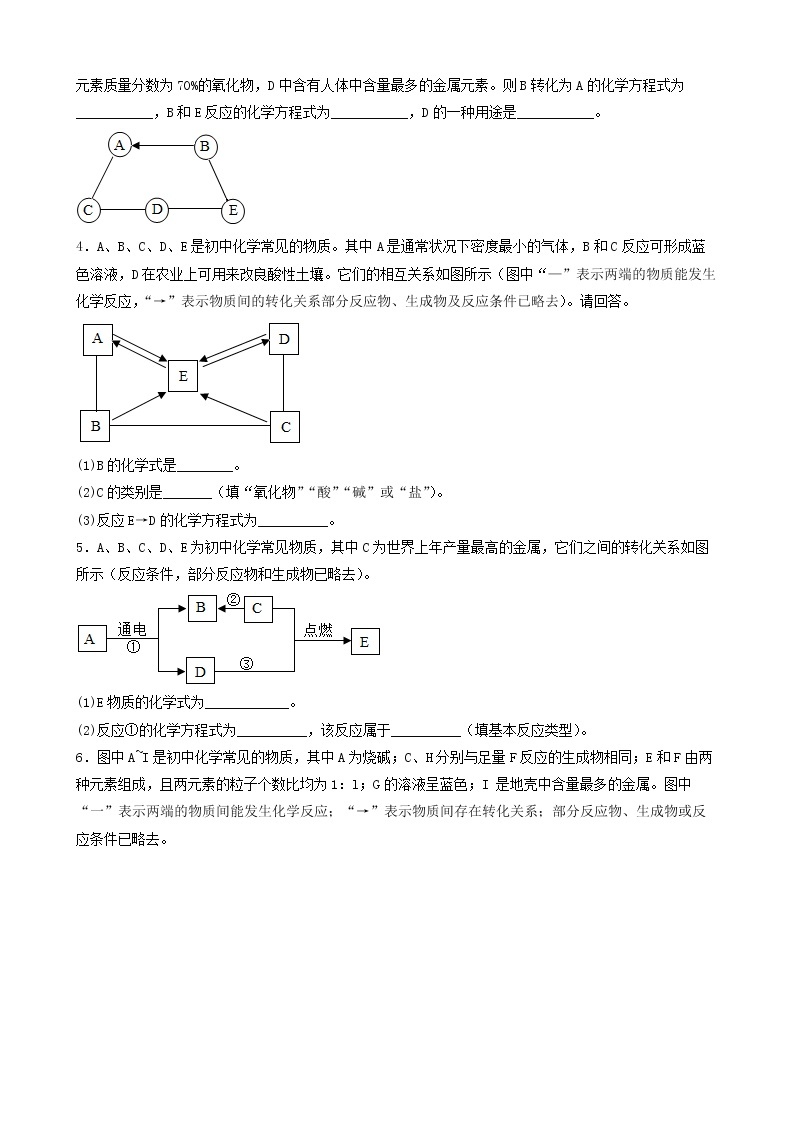
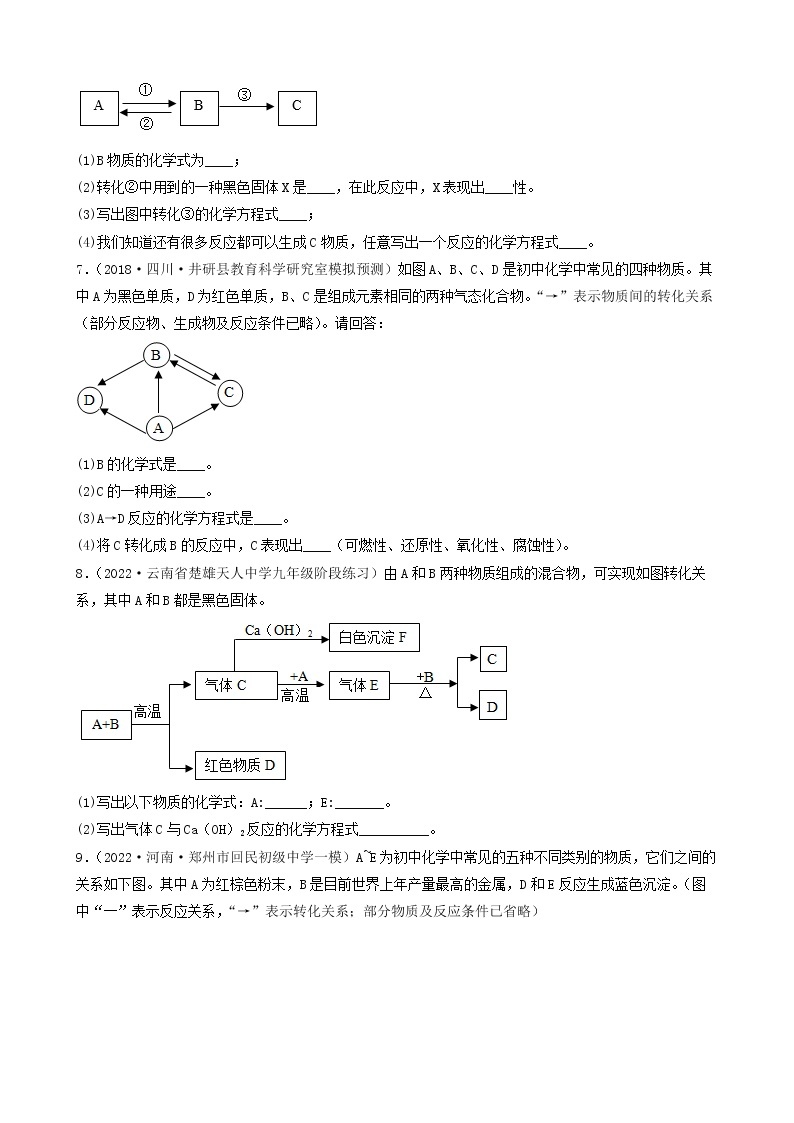
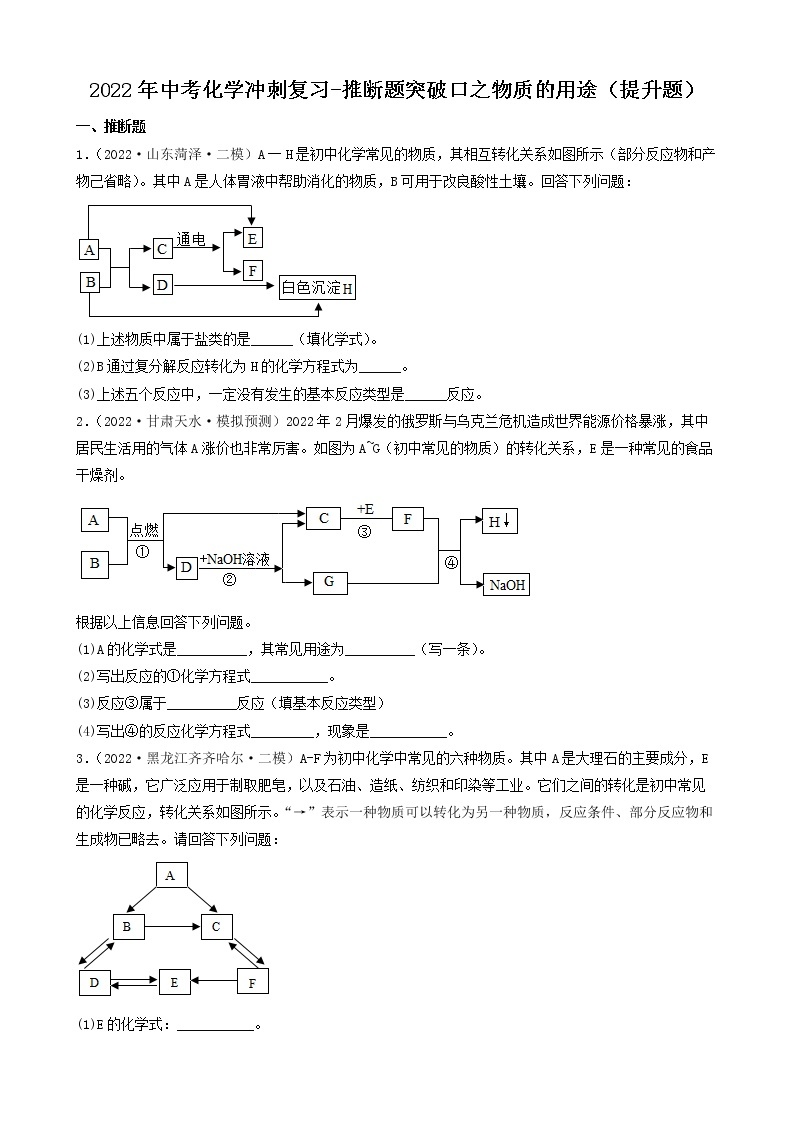
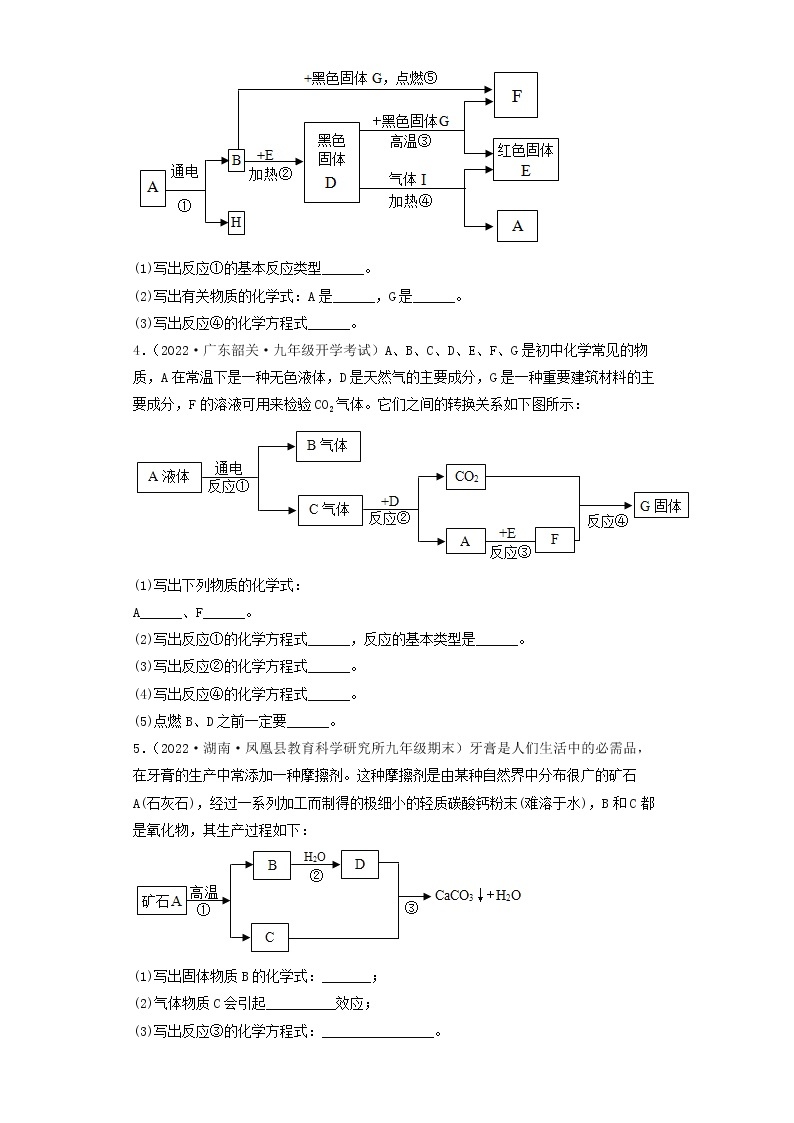
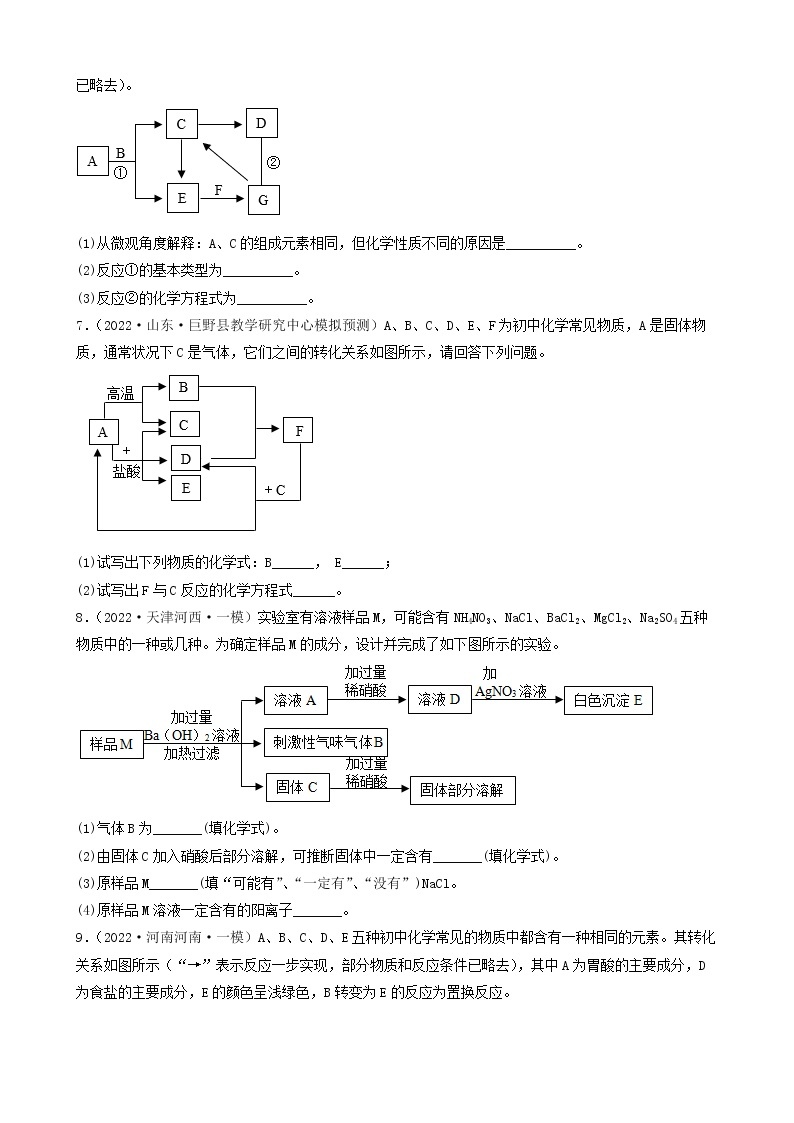
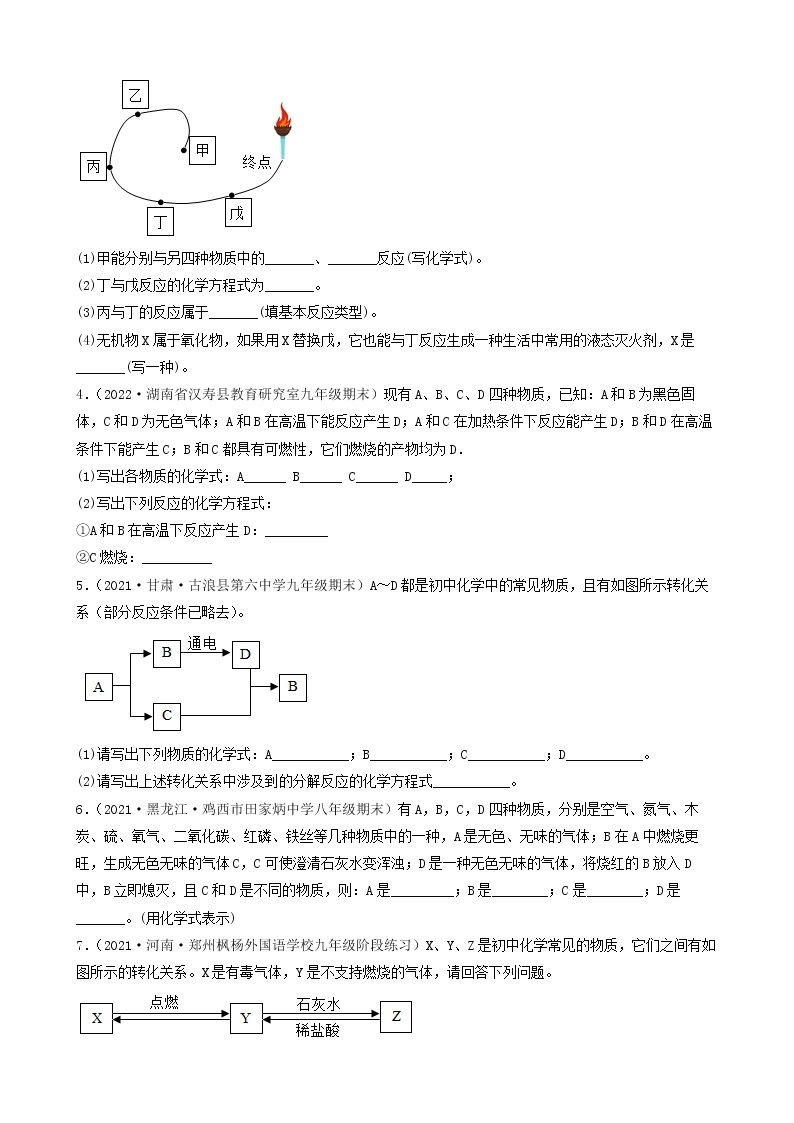
3.(2022·河北承德·九年级期末)A~F是初中化学常见的物质,它们之间的转化关系如图所示(反应条件、部分反应物、生成物已略去)。其中常温下A、E是气体单质,D为红色金属单质。请回答下列问题:
(1)D的化学式为_________。
(2)反应⑥的化学方程式为___________。
(3)E的一种用途___________。
(4)以上物质的转化过程中没有涉及到的基本反应类型是___________。
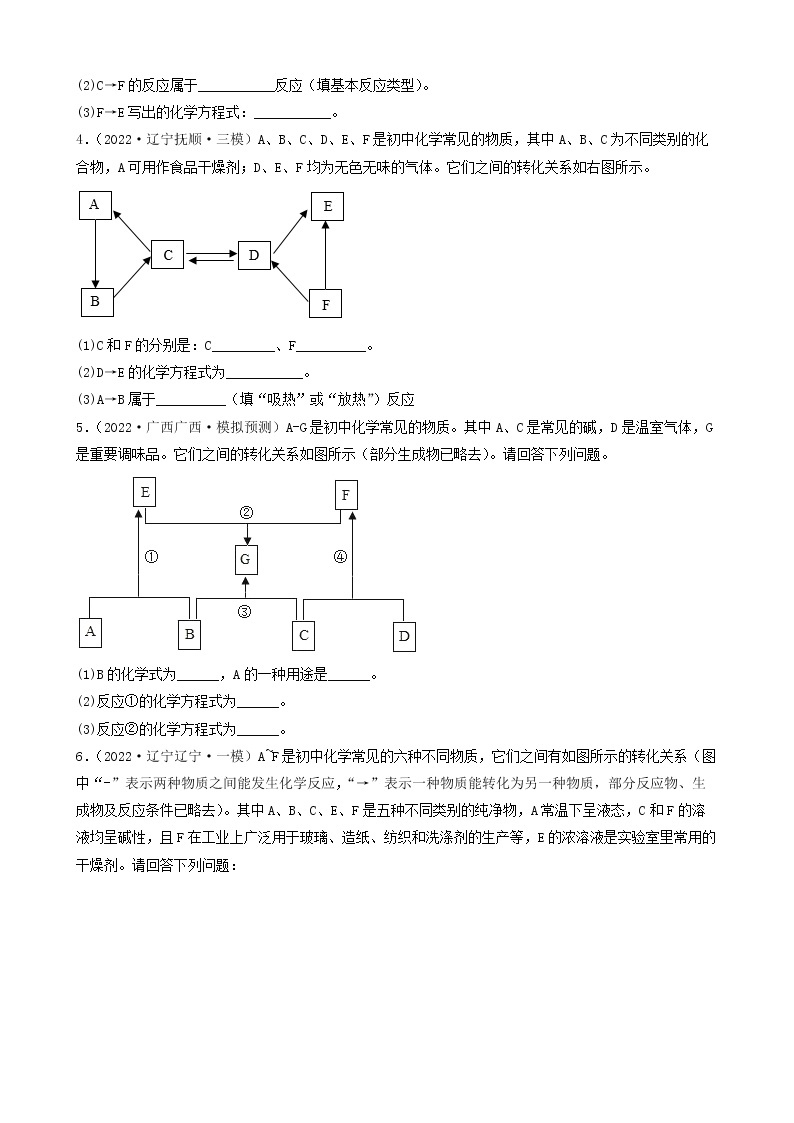
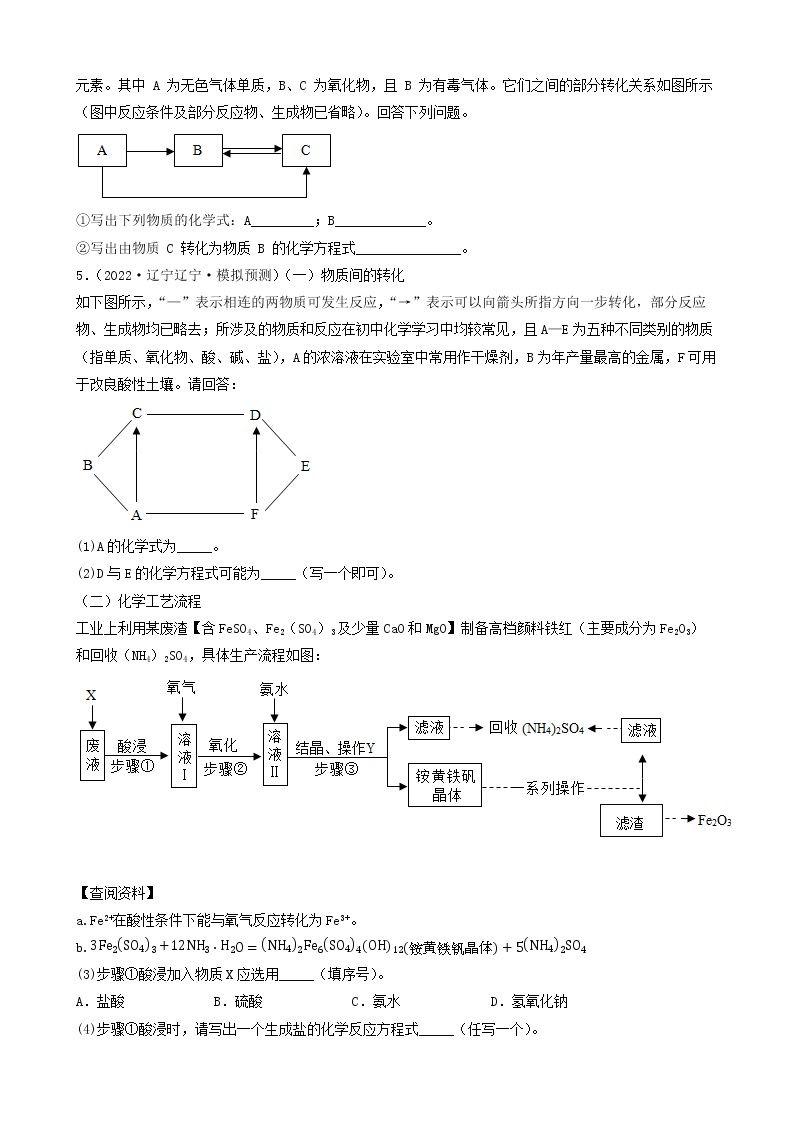
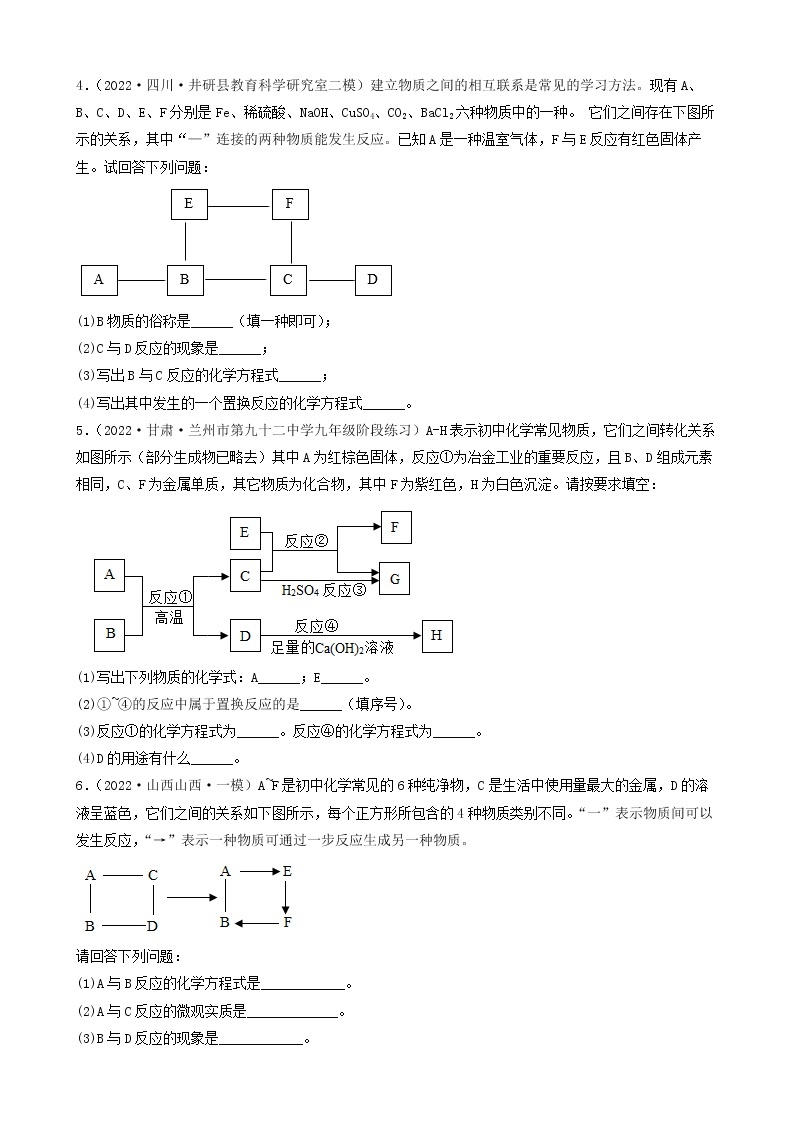
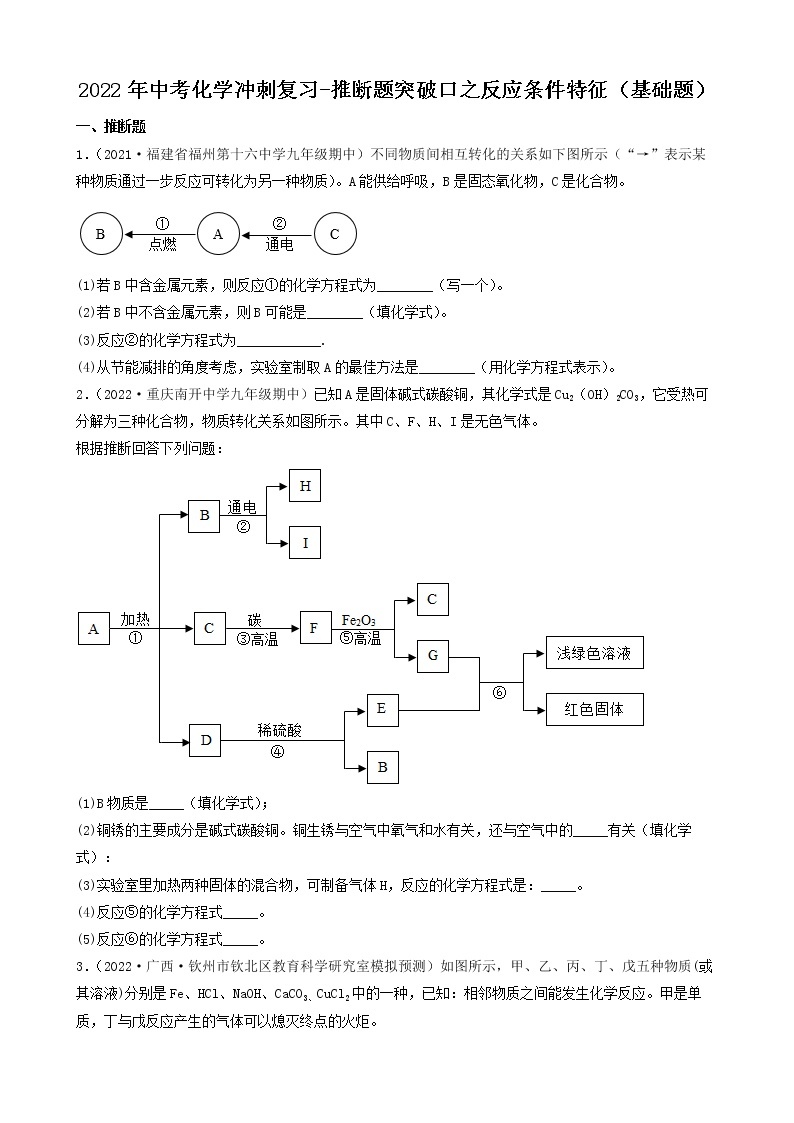
4.(2022·四川·井研县教育科学研究室二模)建立物质之间的相互联系是常见的学习方法。现有A、B、C、D、E、F分别是Fe、稀硫酸、NaOH、CuSO4、CO2、BaCl2六种物质中的一种。 它们之间存在下图所示的关系,其中“—”连接的两种物质能发生反应。已知A是一种温室气体,F与E反应有红色固体产生。试回答下列问题:
(1)B物质的俗称是______(填一种即可);
(2)C与D反应的现象是______;
(3)写出B与C反应的化学方程式______;
(4)写出其中发生的一个置换反应的化学方程式______。
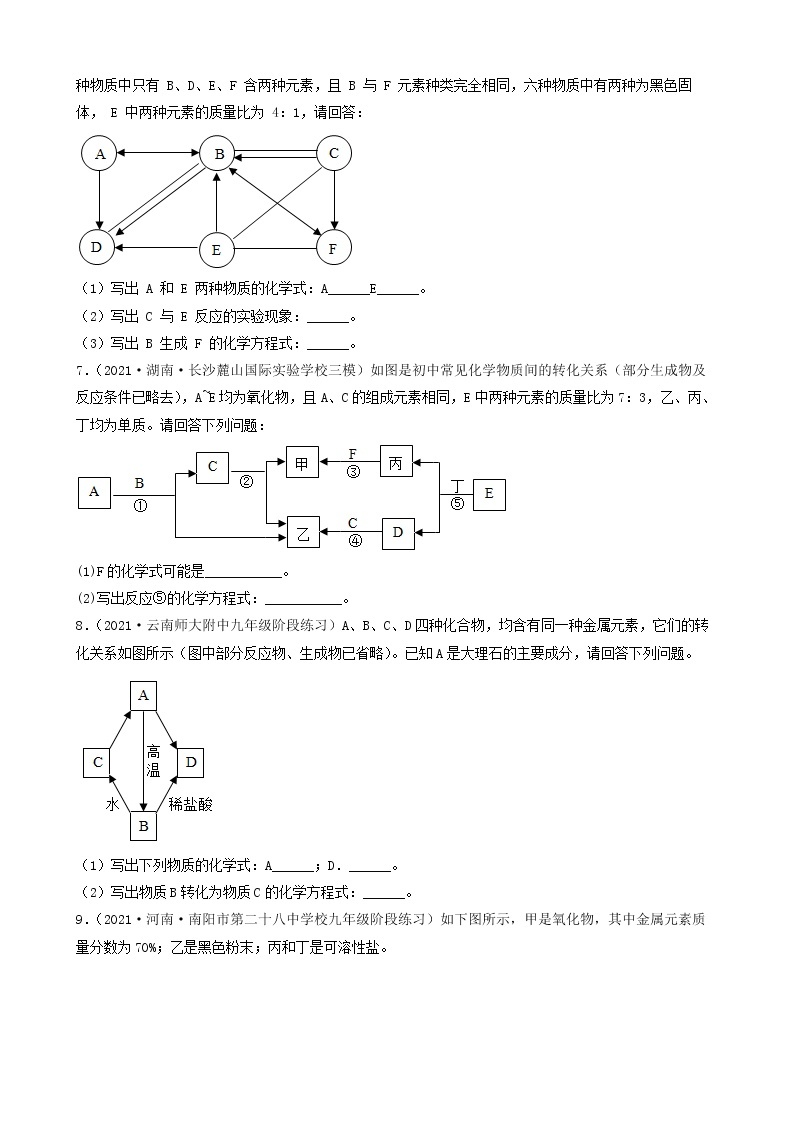
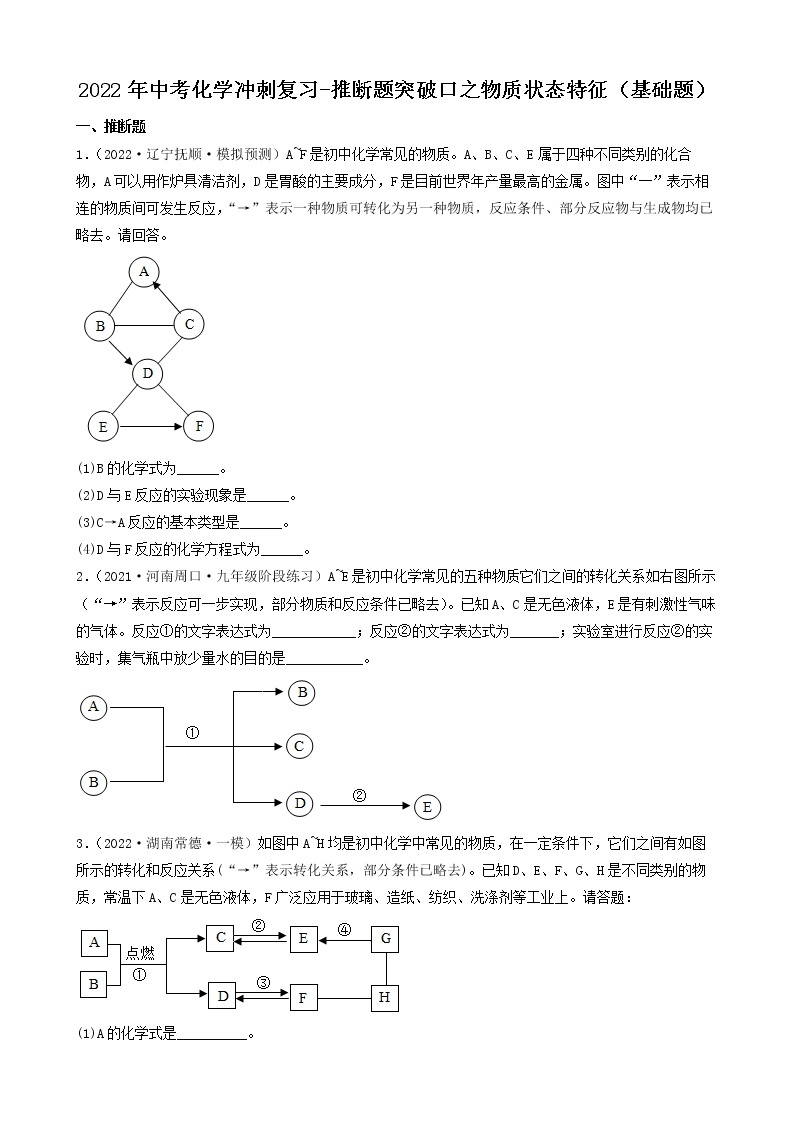
5.(2022·甘肃·兰州市第九十二中学九年级阶段练习)A-H表示初中化学常见物质,它们之间转化关系如图所示(部分生成物已略去)其中A为红棕色固体,反应①为冶金工业的重要反应,且B、D组成元素相同,C、F为金属单质,其它物质为化合物,其中F为紫红色,H为白色沉淀。请按要求填空:
(1)写出下列物质的化学式:A______;E______。
(2)①~④的反应中属于置换反应的是______(填序号)。
(3)反应①的化学方程式为______。反应④的化学方程式为______。
(4)D的用途有什么______。
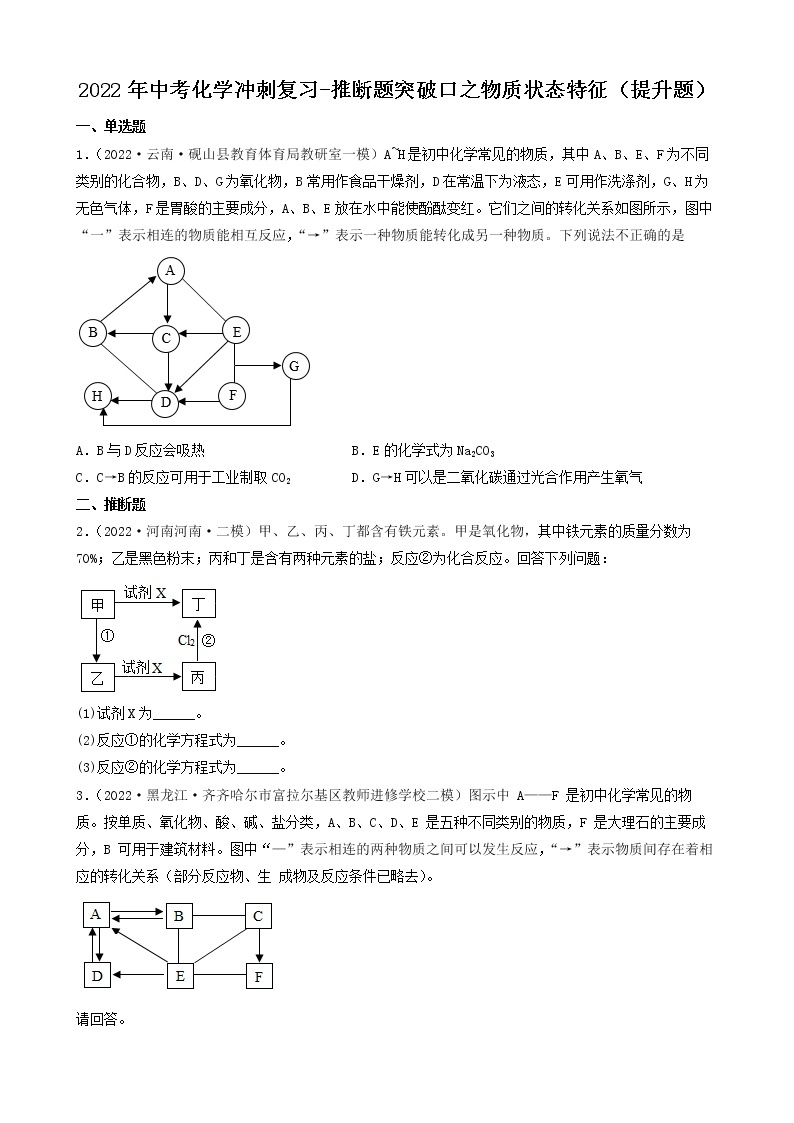
6.(2022·山西山西·一模)A~F是初中化学常见的6种纯净物,C是生活中使用量最大的金属,D的溶液呈蓝色,它们之间的关系如下图所示,每个正方形所包含的4种物质类别不同。“一”表示物质间可以发生反应,“→”表示一种物质可通过一步反应生成另一种物质。
请回答下列问题:
(1)A与B反应的化学方程式是____________。
(2)A与C反应的微观实质是_____________。
(3)B与D反应的现象是____________。
(4)E→F的化学方程式是____________。
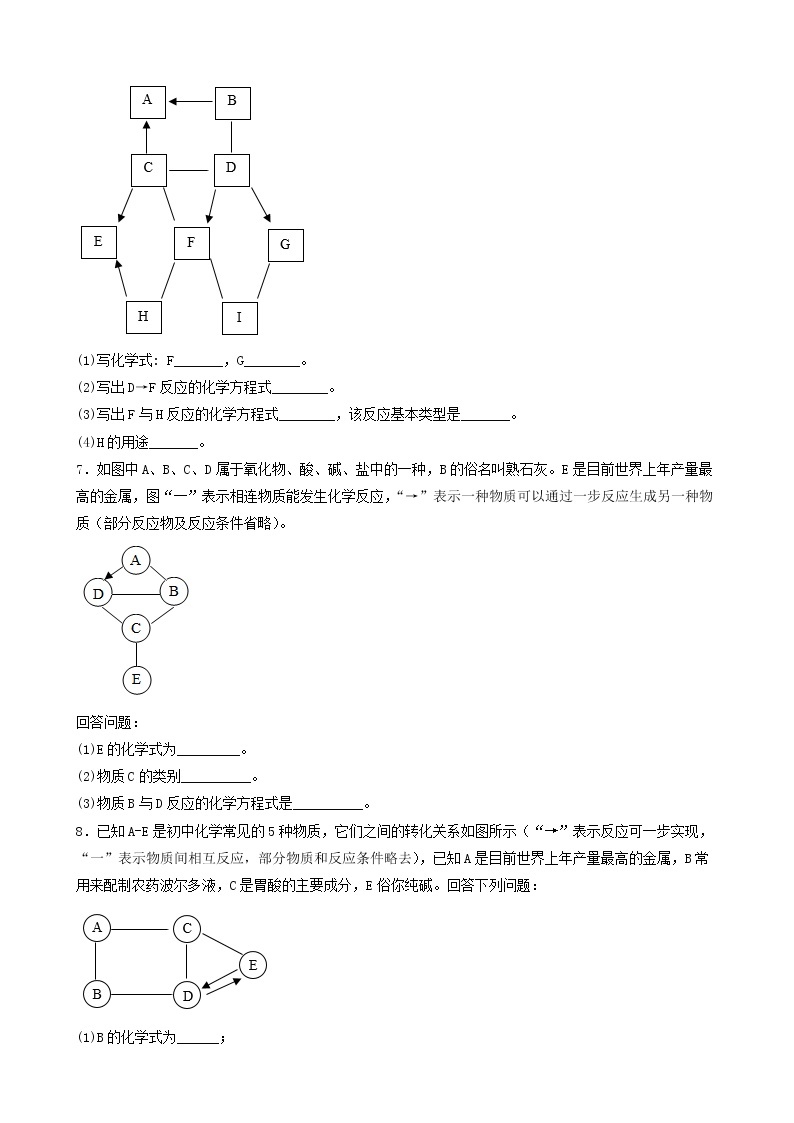
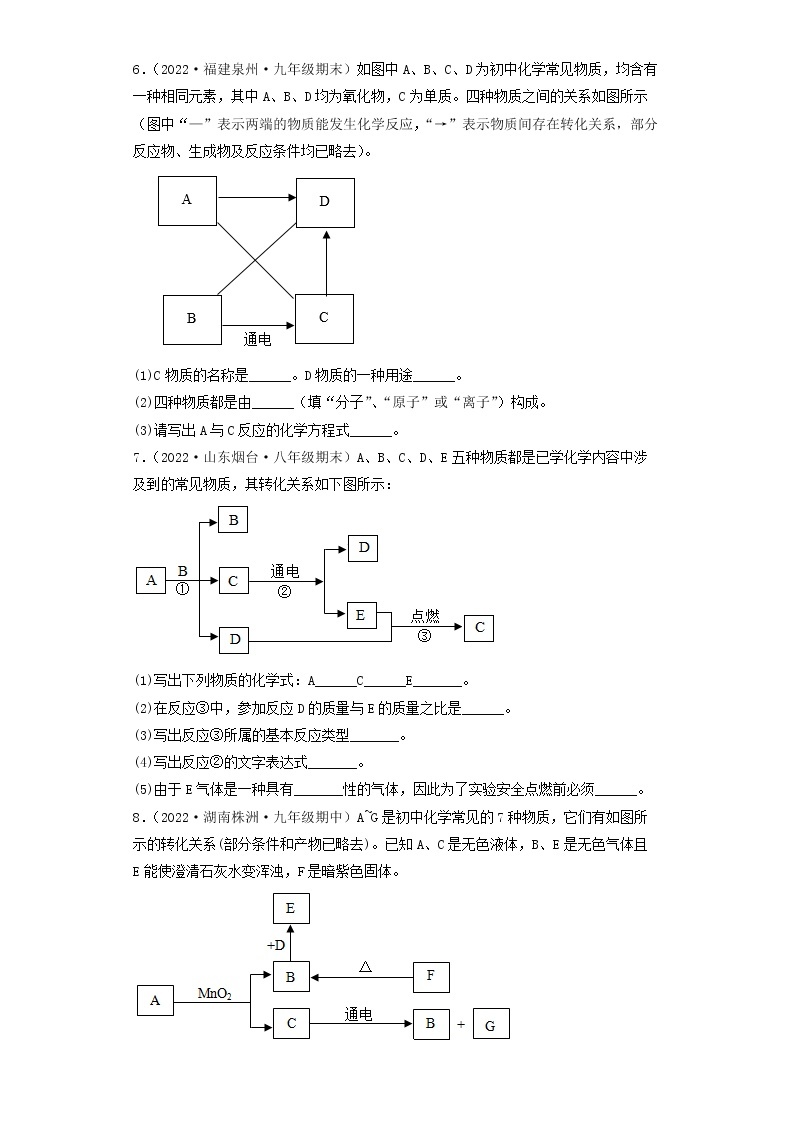
7.(2019·云南·澜沧拉祜族自治县教育科学研究和培训中心二模)A~G是初中化学常见的物质,其中A和B的组成元素相同,且B是最常用的溶剂,E是红色固体,F是黑色粉末,G是用来配制农药波尔多液的蓝色溶液。它们之间的转化关系如下图所示(部分物质及反应条件已略去),请根据提示信息和图示回答下列问题:
(1)A的化学式是_______,F的化学式是__________。
(2)写出F→G反应的化学方程式:__________。
8.(2018·云南·澜沧拉祜族自治县教育科学研究和培训中心一模)下图中A、B、C、D、E为初中常见的五种物质,它们之间存在着如下图所示的转化关系。已知A的俗名为纯碱,B为无色气体,D是石灰石的主要成分,E是蓝色沉淀。根据信息和图示回答问题(反应条件和部分生成物已略去)。
(1)B的化学式_______;C的化学式_______。
(2)写出A→B反应的化学方程式:_______。
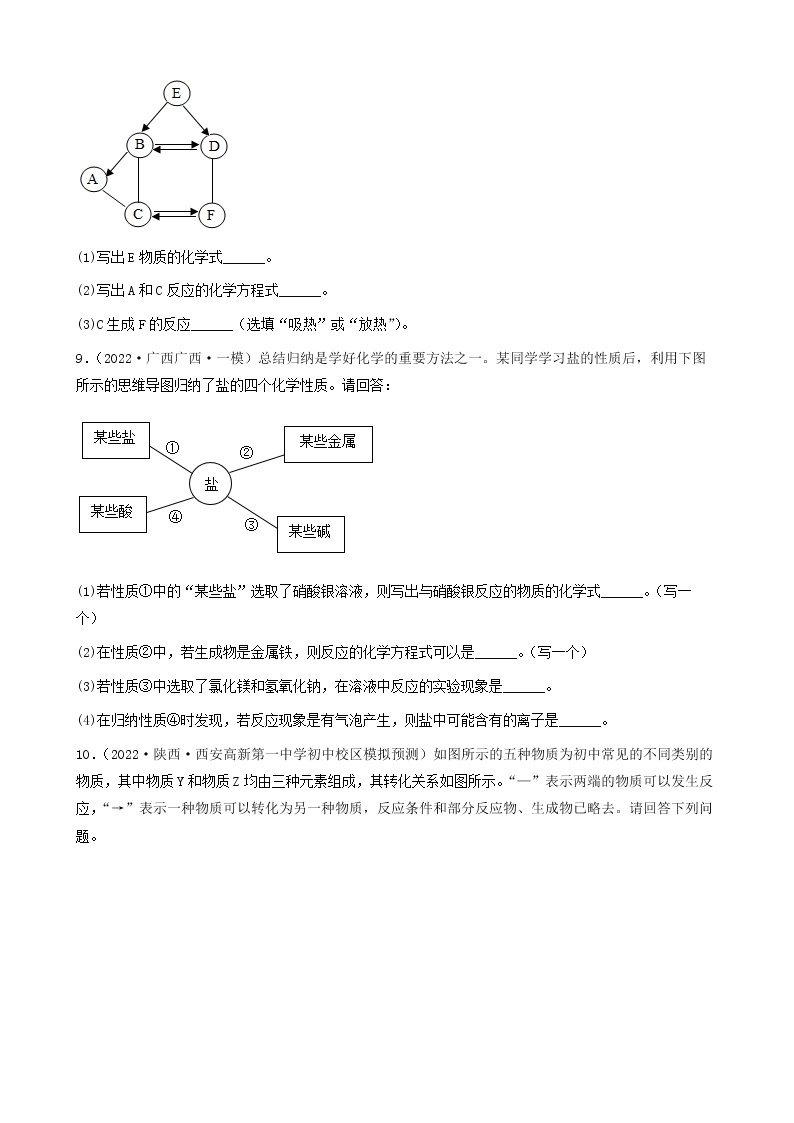
9.(2022·山西晋中·一模)如图所示,该图类似于奥运会的会标一“五环”,相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是初中化学常见的不同类别的物质,其中D物质的溶液呈蓝色。请回答下列问题:
(1)A的化学式为______;
(2)B-C反应的化学方程式为______;
(3)NaOH与D反应的化学方程式为______,该反应能发生的条件是______。
10.(2022·甘肃金昌·模拟预测)现有失去标签的化肥A、B、C、D,它们可能是氯化钾、氨水、硫酸铵、磷矿粉,为了鉴别它们,做了如下实验:
①观察颜色和状态:A呈液态,B为灰白色,C、D是白色晶体;
②取样加水溶解C、D均易溶于水,B不溶:
③取样加熟石灰研磨:D有刺激性气味的气体产生。
请分析推断:A________;B_______;C________。
11.(2022·河南·柘城县实验中学二模)已知甲、乙、丙、X、Y、Z均为初中化学常见物质,甲是一种暗紫色固体,乙、丙为氧化物,X、Y为单质,Z为盐,其中乙是有毒气体,丙为有磁性的黑色固体,Z中只含有两种元素。它们的转化关系如下图所示(部分反应物、生成物及反应条件已略去)。甲→X的反应基本类型为________;Z的化学式为________;X→丙的化学方程式为_________。
12.(2022·江苏·泰州市姜堰区教育局一模)化学世界丰富多彩,A-E是初中化学常见的几种物质,转化关系如图所示。
(1)A的化学式为_______。
(2)D物质含有三种元素,物质D→E的反应方程式为_______;从基本反应类型角度分析,该反应属于_______反应,从质量角度分析,充分反应后溶液的质量会如何变化?_______。
(3)物质C→B的反应方程式为_______,从能量变化角度分析,该反应是_______(填 “放热”或“吸热”)反应。
13.(2022·山西朔州·八年级期中)A、B、C、D是初中化学常见的四种物质,A、B都是黑色固体,C为气体,“一”表示物质间相互反应,“→”表示一种物质生成另一种物质(部分反应物、生成物已略去)。
(1)C的化学式是_______,A可能是______。
(2)为了达到高温条件,可采用的方法是_____,A与B反应的现象为______。
(3)若D→C是化合反应,请你写出一个符合要求的化学方程式:_________。
14.(2022·河南河南·模拟预测)A~E是初中化学常见的不同类别的物质,它们之间的关系如图所示(“→”表示某一种物质经一步反应可转化为另一种物质,“一”表示相连的两种物质能发生化学反应,部分反应物、生成物及反应条件已略去)。已知:A为黑色固体,B中金属元素质量分数为40%,C为一种蓝色沉淀。B的化学式为_________;E→A反应的基本反应类型是_______;A-B的化学方程式为___________。
15.(2022·辽宁抚顺·模拟预测)A~E是五种不同类别的物质,已知A是紫红色固体,D俗称火碱。且A、B、C中含有相同元素,它们之间的关系如图所示(部分反应物,生成物及反应条件已略去),图中“一”表示相连的两种物质之间可以发生反应,“→"表示物质间可以相互转化。
(1)A的化学式是______;
(2)D的一种用途是______;
(3)E的物质类别为______(填“酸”、“盐”或“氧化物”);
(4)若B由三种元素组成,写出C→B反应的化学方程式______。
16.(2022·江西·吉安县城北中学九年级期中)A-G是初中化学常见物质,下图所示是它们之间转化关系。其中:A为红棕色固体,F是黄色溶液,B为单质,A与B或C反应都能生成D和E,B或C与单质甲反应都能生成E,部分反应物、生成物、反应条件省略。请回答下列问题:
(1)实验室检验E的方法为__________。
(2)写出C的一种用途____________。
(3)写出A与G反应的化学方程式____________。
(4)写出A与C反应的化学方程式_____________。
17.(2022·江苏南京·模拟预测)图中A~H是初中化学常见的物质,且分别由H、O、S、Cl、Fe、Cu、Ba中的一种或几种元素组成。F、H为单质,C、E、G由两种元素组成;只有E是氧化物,其中氧元素的质量分数为30%;A、B、C、D四种物质的水溶液颜色不同。图中“一”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。
(1)写出化学式:E______。
(2)写出化学方程式:
A转化为B______;
C与D反应______;
F转化为G______。
18.(2022·河南周口·一模)甲、乙、丙、丁均为初中化学常见的物质。甲、乙是组成元素相同的两种气体,丙为紫红色金属单质。它们有如图所示的转化关系(“→"表示反应一步实现,部分物质和反应条件已略去)。
(1)丁的化学式为______。
(2)乙→丙的化学方程式为______。
(3)写出甲的一种用途______。
19.(2022·甘肃甘肃·模拟预测)已知A~F是初中化学常见的6种物质,它们之间的转化关系如下图所示(“→”表示反应可一步实现,“—”表示物质间相互反应,部分物质和反应条件略去)。已知:B是单质,C是最常用的溶剂,D的水溶液呈蓝色,常用来配制农药波尔多液,F俗称苛性钠。
(1)D的化学式为_______;E的化学式为_______。
(2)D→B反应的化学方程式为_________,基本反应类型为_______。
(3)A→C反应的化学方程式为_________。
20.(2022·辽宁·岫岩满族自治县满族中学一模)有一包白色粉末,'可能是CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种,为探究其组成,进行如下实验:
①取少量的白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。②向实验①滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体。③取少量实验①中所得滤液,将实验②产生的气体通入其中,立即产生白色沉淀。
(1)原混合物中一定含有_______。
(2)原混合物中一定不含_______。
(3)写出实验②所涉及的化学方程式_______。
参考答案:
1.(1)、
(2)、、 NaOH
【解析】
步骤一:取少量固体放入试管中加水充分溶解后,产生浑浊现象,过滤、得到白色沉淀和蓝色溶液,说明白色粉末中一定含有硫酸铜,可能含有碳酸钙、硝酸钡;因为硫酸铜能与氢氧化钠反应生成氢氧化铜蓝色沉淀和硫酸钠,所以白色粉末中一定不含氢氧化钠。步骤二:取少量蓝色溶液,加入足量氯化钡溶液,无明显现象,则此时溶液中不含硫酸根离子,因为步骤一中硝酸钡和硫酸铜反应生成硫酸钡白色沉淀和硝酸铜,说明白色粉末中一定含有硝酸钡。步骤三:取白色沉淀,加入足量的稀硝酸,沉淀部分溶解且产生气泡,说明白色粉末中一定含有碳酸钙,因为碳酸钙与稀硝酸反应生成二氧化碳,有气泡产生。根据上述实验不能确定白色粉末中是否含有氯化钾。
(1)根据分析可知,步骤一得到的白色沉淀是、。
(2)根据分析可知,原白色粉末的成分中一定含有、、,一定不含NaOH。
2.(1)硫酸铜或CuSO4
(2)碳酸钠或Na2CO3 硫酸钠、氯化钡
(3)氯化钠或NaCl
(4)
【解析】
将样品加足量水,溶解,得到无色澄清溶液,说明样品中不含硫酸铜,因为硫酸铜溶液是蓝色的,且硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠,向无色澄清溶液A中加入过量硝酸钡溶液,得到白色沉淀B和无色滤液C,硫酸钠能与硝酸钡反应生成硫酸钡和硝酸钠,碳酸钠能与硝酸钡反应生成碳酸钡和硝酸钠,故白色沉淀可能为硫酸钡或碳酸钡,向白色沉淀B中,加入足量稀盐酸,得到无色气体D和无色溶液E,碳酸钡能与稀盐酸反应生成氯化钡、二氧化碳和水,硫酸钡和稀盐酸不反应,故白色沉淀B为碳酸钡,样品中一定含碳酸钠,一定不含硫酸钠和氯化钡,因为氯化钡能与碳酸钠反应生成碳酸钡和氯化钠,不能共存,向无色滤液C中加入足量稀硝酸和少量硝酸银,得到白色沉淀F,说明含氯化钠,氯化钠能与硝酸银反应生成氯化银白色沉淀。
(1)由实验Ⅰ可知,样品中一定不含有硫酸铜,因为硫酸铜溶液是蓝色的;
(2)由分析可知,实验Ⅲ可得出样品中一定含碳酸钠,一定不含硫酸钠和氯化钡;
(3)根据实验Ⅳ可知,样品中一定含有氯化钠,因为氯化钠能与硝酸银反应生成氯化银和硝酸钠;
(4)实验Ⅱ发生反应为硝酸钡和碳酸钠反应生成碳酸钡和硝酸钠,该反应的化学方程式为:。
3.(1)Cu
(2)
(3)医疗急救
(4)复分解反应
【解析】
根据题目信息可知D为红色金属单质,D为铜;A、E是气体单质,A与B反应能生成C和铜,且A与E反应也能生成C,故可知A是氢气,B是氧化铜,E是氧气;F能生成氢气和铜,故F为活泼金属或稀酸。
(1)根据分析可知D是铜,化学式为Cu;
(2)根据分析可知F是活泼金属或稀酸溶液,故反应⑥可以是铁和稀盐酸的反应,化学方程式为:
;
(3)根据分析可知,E是氧气,能支持呼吸作用,故可用于医疗急救;
(4)反应①是氢气和氧化铜在加热条件下,生成铜和水,⑤是活泼金属与盐溶液生成另一种金属和另一种盐的反应,⑥是活泼金属与酸生成盐和氢气的反应,故①⑤⑥是属于置换反应;反应②是铜和氧气在加热条件下,生成氧化铜的反应,③是氢气和氧气点燃生成水的反应,故②③属于化合反应;反应④是水电解产生氢气和氧气的反应,属于分解反应,故以上反应不涉及的基本反应类型是复分解反应。
4.(1)火碱或烧碱或苛性钠
(2)产生白色沉淀
(3)2NaOH + H2SO4 = Na2SO4 + 2H2O
(4)Fe + CuSO4 = Cu + FeSO4或 Fe + H2SO4 = FeSO4 + H2↑
【解析】
A是一种温室气体,为二氧化碳,二氧化碳和氢氧化钠能反应,B为氢氧化钠,F与E反应有红色固体产生,铁和硫酸铜生成硫酸亚铁和铜,一个是硫酸铜,一个是铁,硫酸铜可以和氢氧化钠反应,E为硫酸铜,F为铁,硫酸可以和铁反应,C为硫酸,剩下D为氯化钡,带入转化关系,符合题意。
(1)由分析可知,B为氢氧化钠,俗称火碱、烧碱、苛性钠。
(2)C硫酸和D氯化钡生成硫酸钡沉淀和盐酸,故填:产生白色沉淀。
(3)B氢氧化钠和C硫酸生成硫酸钠和水,故填:2NaOH + H2SO4 = Na2SO4 + 2H2O。
(4)铁和硫酸铜生成硫酸亚铁和铜,铁和硫酸生成硫酸亚铁和氢气,属于置换反应,故填:
Fe + CuSO4 = Cu + FeSO4或 Fe + H2SO4 = FeSO4 + H2↑。
5.(1)Fe2O3 CuSO4
(2)②③或③②
(3) CO2+Ca(OH)2=CaCO3↓+H2O
(4)灭火(合理即可)
【解析】
A为红棕色固体,反应①为冶金工业的重要反应,则A为氧化铁,B为一氧化碳,B、D组成元素相同,则D为二氧化碳,C为铁,F为金属单质,为紫红色,则F为铜,Fe和E反应生成铜和G,且Fe和硫酸反应生成G,则G为硫酸亚铁,E为硫酸铜,二氧化碳和氢氧化钙反应生成H,H为白色沉淀,则H为碳酸钙。
(1)A为氧化铁,化学式为Fe2O3;
E为硫酸铜,化学式为CuSO4;
(2)反应①是一氧化碳和氧化铁反应生成铁和二氧化碳,反应物都是化合物,不是置换反应,反应②是铁和硫酸铜反应生成硫酸亚铁和铜,为置换反应,反应③是铁和硫酸反应生成硫酸亚铁和氢气,为置换反应,反应④是二氧化碳和氢氧化钙反应生成碳酸钙和水,反应物都是化合物,不是置换反应,故①~④的反应中属于置换反应的是②③;
(3)反应①是一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳,化学反应方程式为: ;
反应④是二氧化碳和氢氧化钙反应生成碳酸钙和水,化学反应方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(4)D为二氧化碳可以用来灭火、作温室气体等。
6.(1)(或等,合理即可)
(2)铁原子变成亚铁离子,氢离子变成氢原子,氢原子结合成氢分子(合理即可)
(3)产生蓝色沉淀,溶液由蓝色变为无色(合理即可)
(4)(或等,合理即可)
【解析】
A~F是初中化学常见的6种纯净物,C是生活中使用量最大的金属,D的溶液呈蓝色,判断C是铁,D是含铜离子的化合物如硫酸铜或氯化铜或硝酸铜等,根据铁能与A反应,根据金属性质,判断A可能是酸,氧气或是盐,由B能和D即铜盐反应也能和A即酸,氧气或是盐反应,故判断B是碱,则A使酸,根据酸的通性可判断,E可能是酸,盐,氢气或是水中的一种物质,根据F能通过反应生成B判断F是碱或是盐或是水,据此分析。
(1)根据分析可知,A和B是酸和碱反应,酸是稀盐酸或是稀硫酸,碱是可溶性碱,故填:或等合理即可;
(2)根据分析可知,A与C反应可能是酸和铁反应,则微观实质是铁原子变成亚铁离子,氢离子变成氢原子,氢原子结合成氢分子(合理即可);
(3)根据分析可知,B与D反应即盐和碱反应,由铜离子能和氢氧根离子化合为氢氧化铜沉淀,故反应现象是:产生蓝色沉淀,溶液由蓝色变为无色(合理即可);
(4)根据分析可知,E→F可能是氢气生成水,或是二氧化碳和碱反应等,故填:
或等,合理即可。
7.(1)H2O2 CuO
(2)CuO + H2SO4=CuSO4 + H2O
【解析】
G是用来配制农药波尔多液的蓝色溶液,G为硫酸铜;E是红色固体,F是黑色粉末,E生成F,F和硫酸生成硫酸铜,则F为氧化铜、E为铜单质;A和B的组成元素相同,且B是最常用的溶剂,AB都能生成C,C与铜反应生成氧化铜,则C为氧气、A为过氧化氢、B为水,过氧化氢分解生成水和氧气,水电解生成氢气和氧气;代入检验推理正确;
(1)由分析可知,A的化学式是H2O2,F的化学式是CuO;
(2)F→G反应为氧化铜和稀硫酸生成硫酸铜和水,CuO + H2SO4=CuSO4 + H2O。
8.(1) CO2 NaOH
(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】
A的俗名为纯碱,A为碳酸钠,碳酸钠能与稀盐酸反应生成二氧化碳,B为无色气体,所以B是二氧化碳,D是石灰石的主要成分,D是碳酸钙,E是蓝色沉淀,E是氢氧化铜,因为C→E,C是氢氧化钠。
(1)B的化学式为CO2;C的化学式为NaOH。
(2)A→B反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
9.(1)H2 (或C)
(2)(合理即可)
(3) 反应物均可溶,生成物中有沉淀,符合复分解反应发生的条件
【解析】
由题干信息知,D物质的溶液呈蓝色且D能与NaOH发生反应,则D为可溶性的铜盐,因D为初中化学常见的物质,所以D为硫酸铜;A、B、C.D分别是不同类别的物质,则A、B、C为单质、氧化物、酸中的一种,因为C能与NaOH发生反应,故C为硫酸(或盐酸);硫酸能与活泼金属、金属氧化物反应,B、C为单质、氧化物中的一种且能发生反应,故B为氧化物,氧化铜(或氧化铁等),A为氢气(或碳)。
(1)由上述分析知,A为具有还原性的单质,则A为H2(或C),故填:H2(或C)。
(2)若B为氧化铜,C为硫酸,则氧化铜与硫酸反应生成硫酸铜和水,反应的化学方程式为:,故填:。
(3)①若D为硫酸铜,则硫酸铜与氢氧化钠反应生成氢氧化铜和硫酸钠,反应的化学方程式为:,故填:。
② 盐和碱发生复分解反应的条件是,反应物盐和碱均可溶,生成物中有气体、沉淀或水生成;硫酸铜与氢氧化钠能发生反应,是因为硫酸铜与氢氧化钠均可溶于水且生成了氢氧化铜沉淀,故填:反应物均可溶,生成物中有沉淀,符合复分解反应发生的条件。
【点睛】
本题是推断题,解答此类题,要善于从题干中找出突破口,然后顺藤摸瓜,推断出各物质。
10.氨水 磷矿粉 氯化钾
【解析】
磷矿粉是灰白色粉末,钾肥、氮肥都是白色晶体。A呈液态,则A为氨水,B为灰白色,B为磷矿粉,C、D是白色晶体,C、D是氯化钾、硫酸铵中的一种。取样加熟石灰研磨:D有刺激性气味的气体产生,则D是硫酸铵,C是氯化钾。
根据以上分析可知,A为氨水,B为磷矿粉,C为氯化钾。
11.分解反应 FeC12
【解析】
根据题意分析:甲是一种暗紫色固体,说明甲是高锰酸钾,如图甲加热生成X,X为单质,推断X是氧气,乙、丙为氧化物,乙是有毒气体,乙中只含有两种元素,丙为有磁性的黑色固体,推断乙是一氧化碳,丙是四氧化三铁,根据乙、丙都能通过反应生成Y,Y为单质,推断Y是铁,Z为盐,Z且中只含有两种元素,Y能反应生成Z,推断Z是铁和盐酸或是铁后的金属的盐酸盐溶液反应生成的氯化亚铁,据此分析。
根据分析可知,甲是高锰酸钾,X是氧气,高锰酸钾加热生成锰酸钾和二氧化锰和氧气,属于一种物质反应生成多种物质,是分解反应;
Z是氯化亚铁,化学式为,;
X→丙即铁在氧气中燃烧生成四氧化三铁,的化学方程式为:。
12.(1)Cu
(2)CuSO4+Fe=FeSO4+Cu或Cu(NO3)2+Fe=Fe(NO3)2+Cu 置换 反应后溶液质量会减少
(3)Cu2(OH)2CO3 2CuO+H2O+CO2↑ 吸热
【解析】
由红色单质A可以转化为黑色物质B,也可以转化为绿色固体C,C又能转化为B,A→B发生的反应为铜与氧气在加热的条件下反应生成氧化铜,则A为Cu,黑色固体B为CuO,C是绿色固体,则A→C是铜生锈生成Cu2(OH)2CO3,C为Cu2(OH)2CO3,D物质中含有三种元素,且为蓝色溶液,B→D是氧化铜与稀硫酸反应生成硫酸铜和水或是氧化铜与稀硝酸反应生成硝酸铜和水,故D为 CuSO4或Cu(NO3)2,E为浅绿色溶液,又是由D转化而来的,D→E是硫酸铜与铁发生置换反应生成硫酸亚铁和铜或是硝酸铜与铁发生置换反应生成硝酸亚铁和铜,因此推断E为FeSO4或Fe(NO3)2,故A为铜、C为Cu2(OH)2CO3、D为 CuSO4或Cu(NO3)2、E为FeSO4或Fe(NO3)2,代入验证正确。
(1)由分析可知:A为铜,B为CuO、化学式为Cu;
(2)由分析可知:D→E是硫酸铜与铁发生置换反应生成硫酸亚铁和铜或是硝酸铜与铁发生置换反应生成硝酸亚铁和铜,故化学方程式为:CuSO4+Fe=FeSO4+Cu或Cu(NO3)2+Fe=Fe(NO3)2+Cu,两个反应都属于置换反应,两个反应中参加反应的铁的质量都小于生成的铜的质量,故反应后溶液质量会减少;
(3)由分析可知:C→B是Cu2(OH)2CO3→CuO,该反应是Cu2(OH)2CO3受热分解生成氧化铜、水和二氧化碳,故化学方程式为:Cu2(OH)2CO3 2CuO+H2O+CO2↑,该反应需要在加热的条件下进行,故为吸热反应。
【点睛】
本题考查物质推断,根据物质的颜色特征进行分析,从而解决问题。
13.(1)CO2 C(或CuO)(合理即可)
(2)给酒精灯加网罩(或使用酒精喷灯) 黑色固体变成红色(合理即可)
(3)(合理即可)
【解析】
A、B都是黑色固体,常见的黑色固体有四氧化三铁、二氧化锰、碳、铁粉、氧化铜等,A、B能在高温条件下反应生成C,C为气体,则A、B中一定有一个是碳,另一个是四氧化三铁或氧化铜,C为CO2。
(1)由分析可知:C的化学式是CO2;A可能是C或CuO或Fe3O4(合理即可);
(2)高温需要温度较高,不能直接用酒精灯加热,要在酒精灯上加一个网罩,可以集中火焰提高温度,也可以直接用酒精喷灯,故为了达到高温条件,可采用的方法是给酒精灯加网罩(或使用酒精喷灯);
若A是C,B是CuO,C与CuO在高温条件下反应生成Cu和CO2,反应的现象为黑色固体变成红色;若A是C,B是Fe3O4,C与Fe3O4在高温条件下反应生成Fe和CO2,反应的现象为无明显现象(合理即可);
(3)化合反应的特征是“多变一”,D可以是氧气,碳完全燃烧生成二氧化碳是化合反应,符合要求,化学方程式为: (合理即可)。
【点睛】
本题考查了物质推断,要知道常见物质的颜色特征和性质,然后根据框图进行分析即可解决问题。
14. CuSO4 化合反应
【解析】
C为一种蓝色沉淀,为氢氧化铜沉淀;氢氧化铜生成A,A为黑色固体,为氧化铜;氧化铜和E可以相互转化,E为铜,铜和氧气生成氧化铜,氧化铜和一氧化碳可以生成铜单质;D能与氢氧化铜、氧化铜反应,D为酸;氧化铜生成B,B生成硫酸铜,且B中金属元素质量分数为40%,B为硫酸铜;
由分析可知:
B的化学式为CuSO4;
E→A反应为铜和氧气生成氧化铜,反应符合多变一特点,属于化合反应;
A-B的反应为氧化铜和硫酸反应生成硫酸铜和水,。
15.(1)Cu
(2)制肥皂、广泛用于石油、造纸、纺织和印染等工业
(3)酸
(4)CuO + H2SO4=CuSO4 + H2 O
【解析】
A是紫红色固体,则A是铜。D俗称火碱则D是氢氧化钠。A、B、C中含有相同元素,则BC中含有铜元素,C可以转化为A和B,B可以转化为A,B可以和氢氧化钠反应,所以B是硫酸铜等可溶性铜盐,C是氧化铜,E可以和氧化铜,氢氧化钠反应则是酸,可以是盐酸或硫酸。代入验证无误。
(1)A是铜,化学式Cu。
(2)D是氢氧化钠,可用于制肥皂、广泛用于石油、造纸、纺织和印染等工业。
(3)根据分析,E为酸。
(4)C→B可以是氧化铜和硫酸反应生成硫酸铜和水,化学方程式为CuO + H2SO4=CuSO4 + H2 O。
16.(1)将气体通入澄清石灰水中
(2)作燃料(或冶炼金属)
(3)或
(4)
【解析】
A-G是初中化学常见物质,其中A为红棕色固体,可推出A为氧化铁,F是黄色溶液,可推出F为铁盐溶液,如氯化铁、硫酸铁,A能与G反应生成F,可推出G为稀盐酸或稀硫酸,A与B或C反应都能生成D和E,B或C与单质甲反应都能生成E,B为单质,可推出B为碳,甲为氧气,C为一氧化碳,E为二氧化碳,D为铁,代入验证,符合题意。
(1)由分析可知,E为二氧化碳,实验室通常用澄清石灰水检验二氧化碳,故可将气体通入澄清石灰水中,澄清石灰水变浑浊,说明生成了二氧化碳;
(2)由分析可知,C为一氧化碳,一氧化碳具有还原性,可用于冶炼金属;‘’
(3)A与G反应可能为氧化铁和稀盐酸反应生成氯化铁和水,该反应的化学方程式为:;或氧化铁和稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:;
(4)A与C反应为一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:。
17.(1)Fe2O3
(2)
【解析】
(1)E是氧化物,其中氧元素的质量分数为30%,Fe2O3中氧元素的质量分数为:=30%,故E为Fe2O3;
(2)F可以和Fe2O3反应,又是单质,F可为H2;A、B、C、D的溶液颜色不同,D由E转化,可以为Fe2(SO4)3,溶液为黄色;C可以与D反应,C可以为BaCl2,溶液为无色;B可以为FeSO4,溶液为浅绿色,也能和BaCl2反应;A可为CuSO4,溶液为蓝色;H可以和CuSO4溶液反应,又为单质,可以为Fe;G可以和Fe反应,由两种元素组成可以为盐酸(HCl)。
A转化为B:硫酸铜与铁反应生成硫酸亚铁和铜,化学方程式为: ;
C与D反应:氯化钡和硫酸铁反应生成硫酸钡和氯化铁,化学方程式为: ;
F转化为G:氯气在氢气中燃烧生成氯化氢,化学方程式为: 。
18.(1)CuO
(2)CO+CuOCu+CO2
(3)灭火或人工降雨等
【解析】
丙为紫红色金属单质,丙是铜,甲、乙是组成元素相同的两种气体,且乙→丙,则乙是一氧化碳,甲是二氧化碳,由于丁丙,丁是氧化铜,将推出的各种物质代入转化关系中进行验证,推断正确。
(1)丁的化学式为CuO;
(2)乙→丙的化学方程式为:;
(3)甲是二氧化碳,二氧化碳可用来灭火或人工降雨等。
19.(1)CuSO4 Na2CO3
(2) 置换反应
(3)
【解析】
C是最常用的溶剂,C是水,D的水溶液呈蓝色,常用来配制农药波尔多液,D是硫酸铜,F俗称苛性钠,F是氢氧化钠。硫酸铜可发生反应生成B,B是单质,则B是铜,铜与氧化铜之间可相互转化,且氧化铜可发生反应生成水,所以A是氧化铜,F与E之间可相互转化,且E能发生反应生成水,E可以是碳酸钠。将推出的各种物质代入转化关系中进行验证,推断正确。
(1)D的化学式为CuSO4,E的化学式为Na2CO3;
(2)D→B反应的化学方程式为:Fe+CuSO4=Cu+FeSO4,基本反应类型为置换反应;
(3)A→C反应的化学方程式为:。
20.(1)碳酸钙、氯化钡、氢氧化钠
(2)硫酸铜、硫酸钠
(3)
【解析】
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,硫酸铜溶液是蓝色的,且形成蓝色沉淀,故白色粉末中一定不含硫酸铜。生成的白色沉淀可能是碳酸钙,也可能是氯化钡和硫酸钠反应生成的硫酸钡;
②向实验①滤出的白色沉淀中加入足量的盐酸,沉淀全部溶解,并产生无色气体,碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,硫酸钡和稀盐酸不反应,说明白色沉淀为碳酸钙,则白色粉末中一定含碳酸钙;
③取少量实验①中所得滤液,将实验②产生的气体通入其中,立即产生白色沉淀,说明白色粉末中含氯化钡、氢氧化钠,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡和氯化钠,氯化钡能与硫酸钠反应生成硫酸钡和氯化钠,不能共存,故白色粉末中不含硫酸钠。
(1)由分析可知,原混合物中一定含有碳酸钙、氯化钡、氢氧化钠;
(2)由分析可知,原混合物中一定不含硫酸铜、硫酸钠;
(3)实验②所涉及的反应为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:。
2023年中考化学冲刺复习推断题模拟新题专练-03推断题突破口之物质状态特征: 这是一份2023年中考化学冲刺复习推断题模拟新题专练-03推断题突破口之物质状态特征,共13页。试卷主要包含了单选题,推断题等内容,欢迎下载使用。
2023年中考化学冲刺复习推断题模拟新题专练-02推断题突破口之反应特征②: 这是一份2023年中考化学冲刺复习推断题模拟新题专练-02推断题突破口之反应特征②,共17页。试卷主要包含了多选题,单选题,推断题,综合应用题等内容,欢迎下载使用。
2023年中考化学冲刺复习推断题模拟新题专练-02推断题突破口之反应特征: 这是一份2023年中考化学冲刺复习推断题模拟新题专练-02推断题突破口之反应特征,共19页。试卷主要包含了单选题,推断题等内容,欢迎下载使用。