

第五章 化工生产中的重要非金属元素-2021-2022学年高一化学期末备考单元复习知识清单(人教版2019必修第二册)
展开
第五章 化工生产中的重要非金属元素知识清单
考点1 硫
1.硫的结构
(1)原子结构示意图,离子结构示意图
(2)性质:在反应中容易得到2个电子形成最外层8电子稳定结构,表现氧化性
(3)常见化合价:-2,0,+4和+6
2.硫元素的自然存在
(1)游离态:主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
硫铁矿
黄铜矿
石膏
芒硝
FeS2
CuFeS2
CaSO4·2H2O
Na2SO4·10H2O
3.硫单质物理性质
(1)色、态:黄色或淡黄色的固体,俗称硫黄
(2)溶解性:不溶于水,微溶于酒精,易溶于二硫化碳
4.硫单质和氯气的氧化性强弱
(1)硫单质的弱氧化性:与变价金属反应生成低价金属硫化物
①FeFeS
②CuCu2S
(2)氯气的强氧化性:与变价金属反应生成高价金属氯化物
①FeFeCl3
②CuCuCl2
5.燃烧反应
(1)氧气的量不同,产物相同:SSO2;SSO2
(2)氧气浓度不同,产物相同,现象不同
①空气:产生微弱的淡蓝色火焰
②氧气:产生明亮的蓝紫色火焰
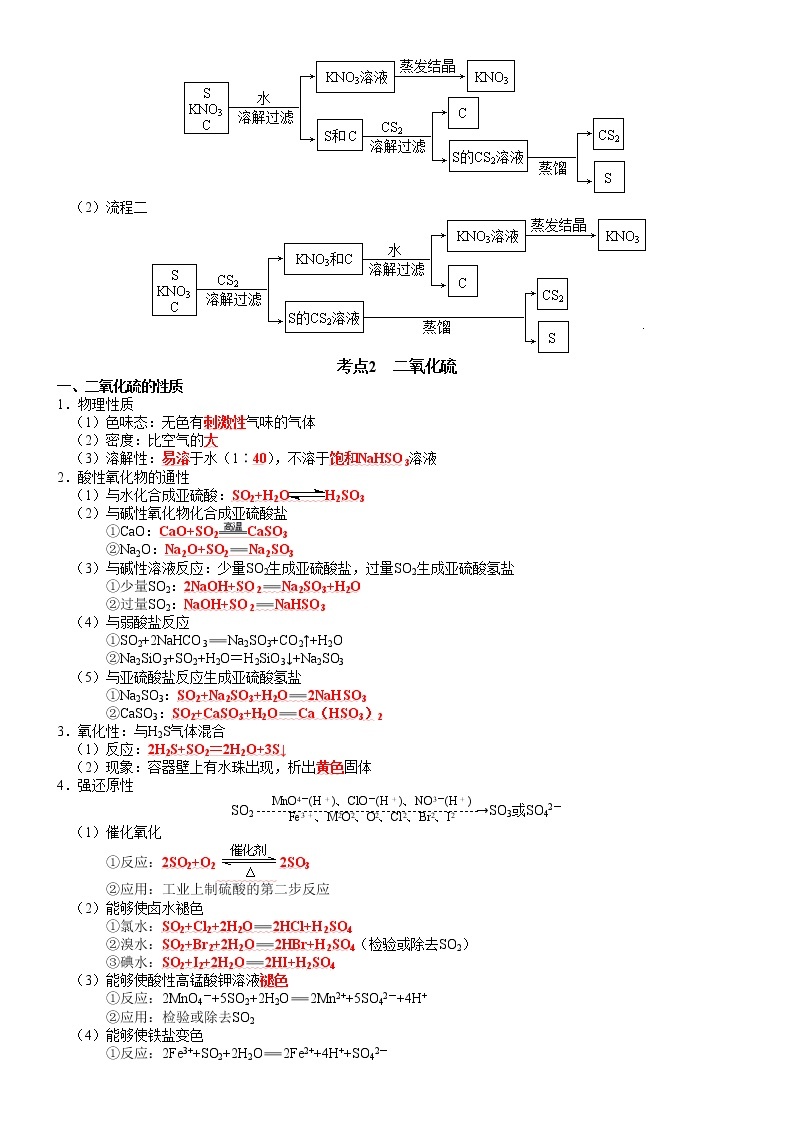
6.两种分离提纯黑火药的流程
(1)流程一
(2)流程二
考点2 二氧化硫
一、二氧化硫的性质
1.物理性质
(1)色味态:无色有刺激性气味的气体
(2)密度:比空气的大
(3)溶解性:易溶于水(1∶40),不溶于饱和NaHSO3溶液
2.酸性氧化物的通性
(1)与水化合成亚硫酸:SO2+H2OH2SO3
(2)与碱性氧化物化合成亚硫酸盐
①CaO:CaO+SO2CaSO3
②Na2O:Na2O+SO2Na2SO3
(3)与碱性溶液反应:少量SO2生成亚硫酸盐,过量SO2生成亚硫酸氢盐
①少量SO2:2NaOH+SO2Na2SO3+H2O
②过量SO2:NaOH+SO2NaHSO3
(4)与弱酸盐反应
①SO2+2NaHCO3Na2SO3+CO2↑+H2O
②Na2SiO3+SO2+H2O=H2SiO3↓+Na2SO3
(5)与亚硫酸盐反应生成亚硫酸氢盐
①Na2SO3:SO2+Na2SO3+H2O2NaHSO3
②CaSO3:SO2+CaSO3+H2OCa(HSO3)2
3.氧化性:与H2S气体混合
(1)反应:2H2S+SO2=2H2O+3S↓
(2)现象:容器壁上有水珠出现,析出黄色固体
4.强还原性
SO2SO3或SO42-
(1)催化氧化
①反应:2SO2+O22SO3
②应用:工业上制硫酸的第二步反应
(2)能够使卤水褪色
①氯水:SO2+Cl2+2H2O2HCl+H2SO4
②溴水:SO2+Br2+2H2O2HBr+H2SO4(检验或除去SO2)
③碘水:SO2+I2+2H2O2HI+H2SO4
(3)能够使酸性高锰酸钾溶液褪色
①反应:2MnO4-+5SO2+2H2O2Mn2++5SO42-+4H+
②应用:检验或除去SO2
(4)能够使铁盐变色
①反应:2Fe3++SO2+2H2O2Fe2++4H++SO42-
②现象:溶液由棕黄色变成浅绿色
(5)能够被过氧化物氧化成硫酸或硫酸盐
①Na2O2:SO2+Na2O2Na2SO4
②H2O2:SO2+H2O2H2SO4
(6)能够将硝酸根离子还原
①2NO3-+3SO2+2H2O3SO42-+2NO↑+4H+
②2NO3-+SO2SO42-+2NO2↑
(7)SO2和氧化性盐溶液的反应
①向BaCl2溶液中通入SO2,没有现象;而向Ba(NO3)2溶液中通入SO2,则会产生白色的BaSO4沉淀。
②向Ca(ClO)2溶液中通入CO2,会产生白色的CaCO3沉淀;而向Ca(ClO)2溶液中通入SO2,则会产生白色的CaSO4沉淀。
5.漂白性
(1)原理:化合性漂白,与某些有色物质(如品红)化合生成无色物质
(2)特点:暂时性漂白,产物不稳定,久置或加热会恢复原色
(3)应用:工业上纸张及草帽编织物的漂白剂
(4)注意
①SO2不能漂白酸碱指示剂,向石蕊试液中通入SO2的现象是溶液变红,但不褪色
②SO2使溴水、酸性高锰酸钾溶液褪色,体现的是SO2的还原性,而不是漂白性
③SO2显红色的酚酞试液褪色,体现的是SO2是一种酸性气体,与碱反应,而不是漂白性
二、实验室制备二氧化硫
1.方法
(1)Na2SO3粉末和中等浓度的硫酸混合;Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O
①不用稀硫酸的原因;SO2易溶于水,逸出SO2的较少
②不用浓硫酸的原因;在Na2SO3表面生成Na2SO4固体,阻止反应持续进行
(2)Cu与浓H2SO4混合加热;Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
2.净化(假设用亚硫酸钠和稀盐酸反应)
(1)先用饱和NaHSO3溶液除HCl
(2)再用浓硫酸或无水氯化钙除水蒸气
3.收集
(1)排液法:排饱和NaHSO3溶液法,导气管长进短出
(2)排气法:向上排空气法,导气管长进短出
4.检验:通入品红溶液,品红褪色,加热又变红
5.尾气:注意导气管末端不能插入液面以下,以防发生倒吸
(1)酸性气体:一般用NaOH溶液吸收
(2)还原性气体:一般用酸性高锰酸钾溶液吸收
三、亚硫酸和亚硫酸盐的性质
1.亚硫酸的性质
(1)弱酸性:H2SO3H++HSO3-
①相对强弱:酸性比碳酸的弱
②实验验证:向饱和NaHCO3溶液中通入足量SO2,将产生的气体先通过足量的酸性高锰酸钾溶液,溶液未完全褪色,再将剩余气体通入澄清石灰水中,溶液变浑浊,则可说明亚硫酸的酸性比碳酸的强
(2)强还原性
①O2:2H2SO3+O22H2SO4
②Cl2:Cl2+H2SO3+H2OH2SO4+2HCl
(3)弱氧化性:2H2S+H2SO33S↓+3H2O
2.亚硫酸钠在空气中变质
(1)变质反应:2Na2SO3+O22Na2SO4
(2)保存方法:密封保存
(3)实验验证:取样→加水溶解→加入足量BaCl2溶液→加入足量盐酸溶液
①完全变质:产生的白色沉淀不溶解
②没有变质:产生的白色沉淀全部溶解
③部分变质:产生的白色沉淀部分溶解
考点3 硫酸 硫酸根离子的检验
一、浓硫酸的性质
1.物理性质
(1)色、态:无色黏稠状液体
(2)溶解性:以任意比和水互溶,同硝酸、乙醇
①热效应:溶解时放出大量的热
②稀释:将浓硫酸沿玻璃棒缓慢倒入水中,边加边搅拌
(3)沸点:338℃,具有难挥发性
(4)浓度和密度
①常用浓硫酸浓度为98.3%,,密度1.84g/cm3,物质的量浓度为18.4mol/L
②浓硫酸中水很少,主要以硫酸分子形式存在
③在写离子方程式时,浓硫酸不能拆写成离子形式,而应该保留化学式形式
④氨气通入浓硫酸的现象是:产生白色沉淀,不能用浓硫酸作为氨气的吸收剂,否则易堵塞导气管
2.浓硫酸与金属单质反应
(1)铝和铁与浓硫酸反应,条件不同,反应不同
①Al、Fe钝化(表现强氧化性)
②Al、Fe剧烈反应,生成硫酸盐和SO2气体(表现酸性和强氧化性)
(2)Au、Pt不反应
(3)氢前的活泼金属(如Zn)与浓硫酸常温反应,先放出SO2气体,后放出H2
①Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O(表现酸性和强氧化性)
②Zn+H2SO4(稀)ZnSO4+H2↑(表现酸性和氧化性)
(4)氢后的不活泼金属(如Cu)与浓硫酸加热反应,先放出SO2气体,后反应停止
①化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(表现酸性和强氧化性)
②离子方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O(不能拆)
3.浓硫酸与碳等非金属单质加热反应
(1)过程:C先放CO2和SO2气体,后反应停止
(2)反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(表现强氧化性)
4.浓硫酸与还原性化合物反应:浓H2SO4SO2
(1)H2S+H2SO4(浓)S+SO2↑+2H2O(表现强氧化性)
(2)2HI+H2SO4(浓)I2+SO2↑+2H2O(表现强氧化性)
(3)2NaBr+2H2SO4(浓)Na2SO4+Br2↑+SO2↑+2H2O(表现酸性、强氧化性)
(4)2FeO+4H2SO4(浓)Fe2(SO4)3+SO2↑+4H2O(表现酸性、强氧化性)
5.浓硫酸的吸水性
(1)含义:吸收自由水或结晶水
(2)变化:化学变化(形成H2SO4·xH2O)
(3)应用:作干燥剂,不能干燥四种气体
①强还原性气体:H2S、HI、HBr
②碱性气体:NH3
6.浓硫酸的脱水性
(1)含义:将有机物中的H、O元素按2∶1脱去
(2)变化:化学变化
(3)实验现象
①纸张、木材、棉花变黑
②湿润的蓝色石蕊试纸先变红后变黑
(4)蔗糖碳化
①现象:蔗糖变黑,体积膨胀,产生大量有刺激性气味的酸雾
②反应:C12H22O1112C+11H2O
C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
③性质:浓硫酸表现脱水性、吸水性和强氧化性
(5)强腐蚀性
①原理:浓硫酸可以脱去皮肤中的水
②不慎将浓硫酸沾在皮肤上的事故处理:先用干布蘸去大量硫酸,再用大量清水冲洗,最后涂3%~5%的碳酸氢钠溶液
7.检验碳与浓硫酸反应所有气体产物
(1)各仪器中的试剂及其作用
①A:CuSO4粉末,检验产生的水蒸气
②B:品红溶液,检验产生的SO2气体
③C:酸性KMnO4溶液或溴水,除去SO2气体
④D:品红溶液,检验SO2能否完全除去
⑤E:澄清石灰水,检验产生的CO2气体
(2)证明有CO2气体的现象
①当D中品红溶液不褪色,E中澄清石灰水变浑浊时,说明产物中CO2气体
②若把装置D去掉,当C中溶液颜色未完全褪去,E中澄清石灰水变浑浊时,说明产物中有CO2气体
二、硫酸根离子的检验
1.常见的干扰反应及排干扰反应或措施
(1)Ag+:Ag++Cl-=AgCl↓,不加氯化物
(2)CO32-:Ba2++CO32-BaCO3↓,CO32-+2H+H2O+CO2↑
(3)SO32-:Ba2++SO32-BaSO3↓,SO32-+2H+H2O+SO2↑
(4)SiO32-:SiO32-+2H+H2SiO3↓,H2SiO3+2OH-SiO32-+2H2O
(5)SO32-和NO3-:3SO32-+2H++2NO3-3SO42-+2NO↑+H2O,溶液中不能同时含H+和NO3-
2.最佳检验流程
(1)加入硝酸钡溶液得到的白色沉淀可能是BaCO3、BaSO3、BaSO4、H2SiO3,并且将NO3-留在溶液中
(2)加入盐酸可以排除BaSO3和BaCO3的干扰,得到的白色沉淀可能是BaSO4、H2SiO3
(3)加入NaOH溶液可以排除H2SiO3的干扰,得到的白色沉淀是BaSO4
考点4 硫及其化合物间的转化关系
1.自然界中不同价态硫元素之间的转化
2.通过氧化还原反应实现含不同价态硫元素的物质之间的转化
3.通过非氧化还原反应实现含不同价态硫元素的物质之间的转化
(1)
(2)
(3)SO3H2SO4→Na2SO4→NaHSO4→BaSO4
4.具体的硫及其化合物之间的转化关系
考点5 氮气和氮的氧化物
一、氮的结构
1.原子结构
(1)原子结构示意图:
(2)在周期表中位置:第二周期第VA族
2.元素存在
3.氮气的分子结构
(1)结构式:N≡N
(2)电子式:
4.常见的含氮微粒
(1)氮元素的化合价与氧化性、还原性的关系
价态
代表物
性质
-3
NH3、Mg3N2、NH4Cl
只有还原性
0
N2
既有氧化性,又有还原性
+1
N2O
+2
NO
+3
N2O3、HNO2、NaNO2
+4
NO2、N2O4
+5
N2O5、HNO3、NaNO3
只有氧化性
(2)氮元素的价-类图
5.自然界中氮的循环
二、氮气的性质和制备
1.物理性质
(1)色味态:无色无味气体
(2)密度:在标准状况下ρ(N2)==1.25g•L-1,比空气的小(极为接近)
(3)溶解性:难溶于水
2.化学性质
(1)稳定性:N≡N键能很大,通常情况下很难发生反应
(2)氧化性:N2+3H22NH3
(3)还原性
①除去中H2的N2:3Mg+N2Mg3N2
②高能固氮反应:N2+O22NO
3.实验室制备氮气
(1)制备原理
①高温下氨气还原氧化铜:2NH3+3CuO3Cu+N2+3H2O
②用饱和NaNO2和NH4Cl溶液反应:NaNO2+NH4ClNaCl+N2↑+2H2O
(2)收集方法:只能用排水法(密度与空气接近,不能用排空气法)
三、氮氧化物的性质
1.氮氧化物的种类
化合价
+1
+2
+3
+4
+5
化学式
N2O
NO
N2O3
NO2
N2O4
N2O5
2.NO的性质
(1)色味态:无色无味气体
(2)溶解性:难溶于水
(3)强还原性:2NO+O22NO2
3.NO2的性质
(1)色味态:红棕色有刺激性气味气体
(2)溶解性:易溶于水,不溶于四氯化碳
(3)与H2O反应:3NO2+H2O2HNO3+NO
(4)强氧化性:能够将某些还原性微粒氧化,自身被还原成NO
还原性微粒
氧化产物
S
SO3或SO42-
I2
Fe3+
①2NO2+2KI=2KNO2+I2(湿润的淀粉碘化钾试纸变蓝,可用于检验NO2)
②NO2+SO2SO3+NO
③H2S+NO2S+NO+H2O
④2Fe2++4H++NO22Fe3++2H2O+NO↑
4.氮氧化物的来源和危害
(1)形成硝酸型酸雨
含氮物质NONO2HNO3
(2)形成光化学烟雾
NO2和O2O3有毒烟雾
(3)破坏臭氧层:NO催化O3分解为O2
NO+O3=NO2+O,NO2+O=NO+O2
(4)水体富营养化:水中含氮化合物引起水体污染
5.氮氧化物的预防和吸收
(1)使用清洁能源,减少氮氧化物的排放
(2)安装汽车尾气转化装置:2NO+2CON2+2CO2
(3)对生产化肥、硝酸工厂的废气进行处理
方法
反应原理
碱液吸收法
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
催化还原法
6NO+4NH35N2+6H2O
CH4+4NO2N2+CO2+2H2O
4H2+2NO2N2+4H2O
2H2+2NON2+2H2O
6.氮氧化物溶于水的计算
(1)NO和NO2的混合气体溶于水时,其反应是3NO2+H2O2HNO3+NO,可利用气体体积变化差值进行计算。
V剩=V原(NO)+V(NO2)
(2)NO2和O2的混合气体溶于水时,其反应是3NO2+H2O2HNO3+NO,2NO+O22NO2,总式为4NO2+O2+2H2O4HNO3。
(3)NO和O2同时通入水中时,其反应是:2NO+O22NO2 ,3NO2+H2O2HNO3+NO,总式为4NO+3O2+2H2O4HNO3。
7.实验室制一氧化氮和二氧化氮
(1)药品:铜和稀(浓)硝酸
或或
(2)反应
①NO2:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
②NO:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
(3)收集
①NO:只能用排水法收集或排“惰性”气体法
②NO2:向上排空气法或排四氯化碳法
(4)检验
①NO:通入空气,产生红棕色气体
②NO2:通过湿润的淀粉碘化钾试纸变蓝
(5)尾气
①NO:一般用酸性的H2O2、酸性高锰酸钾溶液等强氧化性溶液吸收
②NO2:一般用NaOH、Na2CO3等碱性溶液吸收
(6)制NO前,先通氮气等气体将装置内的空气排尽
考点6 氨和铵盐
一、氨气和氨水的性质
1.氨气的物理性质
(1)色味态:无色、有刺激性气味的气体
(2)密度:比空气的小
(3)溶解性:极易溶于水,1∶700,难溶于CCl4
(4)物理特性:易液化(沸点-33.5℃)
2.碱性气体
(1)水:NH3+H2ONH3·H2O
(2)指示剂:能够使紫色石蕊试液变蓝,酚酞试液变红
(3)盐酸
①反应:NH3+HClNH4Cl
②现象:遇挥发性酸产生白烟,同浓硝酸
③应用:检验氨气
(4)硫酸:2NH3+H2SO4(NH4)2SO4
3.氨气的还原性
(1)催化氧化:4NH3+5O24NO+6H2O
(2)热的CuO:2NH3+3CuON2+3Cu+3H2O
(3)将氮氧化物还原为无毒的氮气
①6NO+4NH35N2+6H2O
②6NO2+8NH37N2+12H2O
(4)还原氯气
①少量NH3:2NH3+3Cl26HCl+N2
②过量NH3:8NH3+3Cl26NH4Cl+N2
4.氨气的用途
(1)制硝酸和硝酸铵:N2NH3NONO2HNO3NH4NO3
(2)致冷剂:液氨气化时要吸收大量的热,使周围的温度急剧降低
(3)制化肥:制备硝铵、硫铵、氯铵、碳铵等铵态氮肥
5.氨气的喷泉实验
(1)实验装置
(2)操作步骤:先打开止水夹→再挤胶头滴管
(3)形成条件:产生较大的压强差
①气体完全被液体吸收剂溶解或反应
②气体和气体完全反应生成固体或液体
③气体冷凝成液体使气压减小
④液体变成气体使气压增大
⑤外界气压压缩气体
二、氨水的性质
1.氨水的密度
(1)比水小,浓度越大,密度越小
(2)质量分数为a和b的两种氨水混合
①等质量混合,所得氨水的质量分数c=
②等体积混合,所得氨水的质量分数c<
2.氨水的挥发性:易挥发出氨气,所以氨水应密封保存
3.氨水的组成
(1)三个可逆反应
①氨气和水的反应:NH3+H2ONH3·H2O
②一水合氨的电离:NH3·H2ONH4++OH-
③水的电离:H2OH++OH-
(2)“三分子”、“三离子”成分
①三分子:NH3、H2O、NH3·H2O
②三离子:NH4+、OH-、H+
4.氨水的化学性质
(1)不稳定性:NH3·H2ONH3↑+H2O
(2)弱碱性
①H2SO4:2NH3·H2O+H2SO4(NH4)2SO4+2H2O
②少量CO2:2NH3·H2O+CO2(NH4)2CO3+H2O
③过量CO2:NH3·H2O+CO2NH4HCO3
④AlCl3:AlCl3+3NH3·H2OAl(OH)3↓+3NH4Cl
三、铵盐的性质及检验
1.物性:都是无色,易溶于水的晶体
2.热不稳定性
(1)非氧化性酸铵盐氨气和相应的酸
①碳酸铵:(NH4)2CO32NH3↑+H2O↑+CO2↑
②碳酸氢铵:NH4HCO3NH3↑+H2O↑+CO2↑
③亚硫酸铵:(NH4)2SO32NH3↑+H2O↑+SO2↑
④氯化铵:NH4ClNH3↑+HCl↑
(2)氧化性酸铵盐复杂的氧化还原反应,一般不放氨气
①NH4NO3N2O↑+2H2O
②5NH4NO32HNO3+4N2↑+9H2O
③2NH4NO32N2↑+O2↑+4H2O
④3(NH4)2SO44NH3↑+3SO2↑+N2↑+6H2O
3.铵盐和碱反应
(1)条件不同,产物不同
①常温:NH4++OH-NH3·H2O
②加热:NH4++OH-NH3↑+H2O
(2)注意事项
①铵态氮肥不能与碱性物质混合使用,以免生成氨气,降低肥效。
②铵盐固体和碱固体反应时,不能拆写成离子形式
③酸式铵盐和碱溶液反应时,注意碱过量时,NH4+和酸式酸根离子都参与反应
4.铵盐的检验
(1)步骤:取样,加碱,加热,加湿润的红色石蕊试纸
(2)现象:湿润的红色石蕊试纸变蓝
5.实验室制氨气
(1)反应:2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2
(2)净化:用碱石灰吸水
(3)收集
①方法:向上排空气法和排四氯化碳液体法
②试管口堵棉花的作用:防止氨气和空气发生对流,提高氨气的收集速率和纯度
(4)尾气:棉花用稀硫酸浸湿,注意防倒吸
(5)以氨水为原料制氨气的方法和装置
①装置:“固体+液体→气体”型
②方法:浓氨水和NaOH固体或生石灰混合
③原理:NaOH固体溶于水放热(氧化钙和水反应放热)使浓氨水分解
考点7 硝酸
六、硝酸的性质
1.物理性质
(1)色味态:纯硝酸是一种无色有刺激性气味的液体
(2)密度:比水的大,密度越大,浓度越越大,常见浓硝酸浓度为68%~70%
(3)溶解性:以任意比和水互溶
(4)挥发性:易挥发,浓度为95%以上的硝酸称为发烟硝酸
2.不稳定性
(1)反应:4HNO34NO2↑+O2↑+H2O
(2)通常所见的浓硝酸因含NO2而呈黄色
①除去黄色最简单的方法:加水,3NO2+H2O2HNO3+NO
②除去黄色最环保的方法:通足量氧气,4NO2+O2+2H2O4HNO3
3.与金属单质反应
(1)Al、Fe:遇到浓硝酸,常温钝化,加热剧烈反应放NO2气体
(2)Au、Pt:任何情况下都不反应
(3)其他金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同
①浓硝酸与银反应:Ag+2HNO3(浓)AgNO3+NO2↑+H2O
②稀硝酸与银反应:3Ag+4HNO3(稀)3AgNO3+NO↑+2H2O
4.与碳反应
(1)碳与浓硝酸加热反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O
(2)碳与稀硝酸不反应
5.硝酸与还原性化合物反应
(1)-2价硫:3H2S+2HNO3(稀)3S↓+2NO↑+4H2O
(2)+4价硫:3Na2SO3+2HNO3(稀)3Na2SO4+2NO↑+H2O
(3)-2价碘:6I-+8H++2NO3-3I2+2NO↑+4H2O
(4)+2价铁:3Fe2++4H++NO3-3Fe3++2H2O+NO↑
6.几种物质和湿润的蓝色石蕊试纸的反应
(1)湿润的蓝色石蕊试纸先变红,后褪色
(2)湿润的蓝色石蕊试纸只变红,不褪色
(3)湿润的蓝色石蕊试纸先变红,后变黑
(4)湿润的蓝色石蕊试纸只变红,不褪色
(5)湿润的蓝色石蕊试纸先变红,后褪色
(6)湿润的蓝色石蕊试纸只变红,不褪色
7.浓硝酸的保存
(1)易挥发:密封保存,敞口放置,质量减小,浓度降低
(2)易分解:棕色细口瓶避光、黑暗而且温度低的地方
(3)强氧化性:不能用橡胶塞,而用玻璃塞
(4)大量存放:铝制或铁制的槽车内
七、金属与硝酸反应的计算
1.硝酸与金属反应的规律
硝酸与金属单质反应时一部分被还原,一部分生成硝酸盐,故硝酸既表现了酸性又表现了氧化性,但硝酸与金属反应一般不生成H2。
(1)硝酸与铜的反应:
在反应中硝酸的作用可用下图表示:
可以看出,随HNO3浓度的降低,还原产物会由NO2变成NO。
①由氮原子守恒可知,无论是NO2还是NO,被还原的硝酸与被还原生成气体的物质的量总是相等的;
②未被还原的NO3-与Cu2+构成Cu(NO3)2,NO3-的物质的量为Cu2+物质的量的2倍;
③运用电子守恒、原子守恒,便可顺利求解参加反应的Cu、HNO3以及产物NO2、NO之间量的关系。
(2)稀硝酸与铁的反应:
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O ①
3Fe(过量)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O ②
反应物的量与生成物的关系如图所示:
上述反应首先发生反应①,若Fe剩余再发生反应③Fe+2Fe(NO3)3=3Fe(NO3)2,合并①③即可得反应②。所以,无论反应①还是反应②,被还原的HNO3皆占参与反应的HNO3的。
2.常用解题方法
(1)原子守恒:n(HNO3)=n(NO3-)+n(还原产物中氮原子)。
(2)电子守恒:硝酸与金属反应属于氧化还原反应,氮原子得到的电子数等于金属原子失去的电子数。
(3)利用离子方程式计算:
硝酸与硫酸混合液跟金属的反应,当金属足量时,不能用硝酸与金属反应的化学方程式计算,应用离子方程式计算,因为生成的硝酸盐中的NO3-借助硫酸中的H+仍能继续与金属反应。
考点8 无机非金属材料
一、硅酸盐材料
1.结构和性质
(1)结构:硅氧正四面体
(2)性质
①物理性质:大多硬度高、熔点高、难溶于水
②化学性质:大多化学性质稳定、耐腐蚀
2.分类
(1)陶瓷
①原料:黏土(主要成分为含水的铝硅酸盐)
②制备流程:黏土陶瓷
③应用:制建筑材料、绝缘材料、日用器皿、卫生洁具
(2)玻璃
①原料:纯碱、石灰石和石英砂
②成分:Na2SiO3、CaSiO3、SiO2
③制备流程
④用途:制建筑材料、光学仪器、各种器皿、玻璃纤维
(3)水泥
①原料:石灰石和黏土
②制备流程
③用途:制建筑材料,如混凝土(水泥、沙子、碎石)
【注意】传统无机非金属材料的主要成分都是硅酸盐,都是混合物,都没有固定的熔沸点
二、新型无机非金属材料
1.硅和二氧化硅
(1)硅元素的自然存在
①硅酸盐:地壳中的大多数矿物
②二氧化硅:如水晶、玛瑙等
(2)硅和二氧化硅的用途
①晶体硅:制芯片和硅太阳能电池
②二氧化硅:制造光导纤维
(3)高纯硅的制备
①SiO2+2CSi+2CO↑
②Si+3HClSiHCl3+H2
③SiHCl3+H2Si+3HCl
2.新型陶瓷
(1)组成:不是传统的硅酸盐体系
(2)性能:光学、热学、电学、磁学等新特性和功能
(3)代表物:碳化硅(SiC)
①俗名:金刚砂
②结构:原子间通过共价键结合,类似于金刚石
③硬度:很大,可作砂纸和砂轮的磨料
④熔点:很高,具有高温抗氧化性能
3.碳纳米材料
富勒烯
碳纳米管
石墨烯
结构
由碳原子构成的一系列笼形分子的总称
由石墨片层卷成的管状物,有纳米尺度的直径
只有一个碳原子直径厚度的单层石墨
关系
都是碳单质,互为同素异形体
性质
比表面积大,有很高的强度和优良的电学性能
电阻率低、热导率高,具有很高的强度
用途
C60,开启了碳纳米材料研究和应用的新时代
生产复合材料、电池和传感器等
制光电器件、超级电容器、电池和复合材料
第5章 化工生产中的重要非金属元素——【期末复习】高一化学单元复习知识点梳理(人教版2019必修第二册): 这是一份第5章 化工生产中的重要非金属元素——【期末复习】高一化学单元复习知识点梳理(人教版2019必修第二册),共14页。
第五章 化工生产中的重要非金属元素(B卷)【过习题】-2022-2023学年高一化学单元复习(人教版2019必修第二册): 这是一份第五章 化工生产中的重要非金属元素(B卷)【过习题】-2022-2023学年高一化学单元复习(人教版2019必修第二册),文件包含第五章化工生产中的重要非金属元素B卷过习题-2022-2023学年高一化学单元复习过过过人教版2019必修第二册解析版docx、第五章化工生产中的重要非金属元素B卷过习题-2022-2023学年高一化学单元复习过过过人教版2019必修第二册原卷版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
第五章 化工生产中的重要非金属元素(A卷)【过习题】-2022-2023学年高一化学单元复习(人教版2019必修第二册): 这是一份第五章 化工生产中的重要非金属元素(A卷)【过习题】-2022-2023学年高一化学单元复习(人教版2019必修第二册),文件包含第五章化工生产中的重要非金属元素A卷过习题-2022-2023学年高一化学单元复习过过过人教版2019必修第二册解析版docx、第五章化工生产中的重要非金属元素A卷过习题-2022-2023学年高一化学单元复习过过过人教版2019必修第二册原卷版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。












