



2021届高考化学三轮复习专项冲刺:化学反应机理历程、活化能 、 催化剂(一)课件PPT
展开2021年热门考点基于真实情境,考查学生综合运用知识的能力 , 与化工生产关系密切的催化剂 , 主要从反应历程 、 活化能 、 速率 、 平衡移动等,考查催化剂对反应的影响 。 从试题形式上看 , 常常融合图像 、 表格等信息呈现形式 ,考查学生吸收和整合陌生信息的能力 。
催化剂如何影响化学反应 ?例如: Cu 催化乙醇的氧化反应:2Cu + O2 =^=2C u O;CH3CH2OH + CuO =^= CH3CHO + Cu + H2O催化剂 Cu 先参与反应后又重新生成,它经历了 Cu-CuO-Cu 的变化历程。
01.催化剂与反应历程
[ 例 1 ] 用 NaCIO3、 H2O2 和稀硫酸制备 CIO2 ,反应开始时加入少量盐酸 ,CIO2 的生成速率大大提高 ( CI- 对反应有催化作用 ) 。 该过程可能经两步反应完成 , 将其补充完整 : ① ____________________( 用离子方程式表示 ); ② H2O2 + CI2 =2CI— +O2 + 2H+
解析:第②步中 CI2 生成 CI—, 可知催化制 CI— 的变化历程是: CI—___CI2 — CI—, 即 CI— 在第①步中变成 CI2 由题给信息及氧化还原知识可知 , 氧化剂是 CIO3—, 且 CIO3—反应后生成CIO2 , 离子方程式 :2CIO3— + 2CI— +4H+ =2CIO2 +CI2 + 2H2O
例 2. 在 Cu/ZnO 催化剂存在下 , C02 和 H2 可发生两个平行反应 : Ⅰ. CO2(g) + 3H2(g) =^= CH3OH(g) + H2O(g) ; Ⅱ.CO2(g) + H2(g) =^= CO(g) + H2O(g) 某实验室控制 C02 和 H2 初始投料比为 1 : 2.2 , 在相同压强下 , 经过相同时间测得实验数据如下表所示 。 在图中分别画出反应 I 在无催化剂 、 有 Cat.1和有 Cat.2 三种情况下"反应过程一能量"示意图
02.催化剂与活化能 、 焓变
催化剂通过降低反应的活化能,从而加快反应速率 。 催化剂的性能越好 , 反应的活化能越低 。
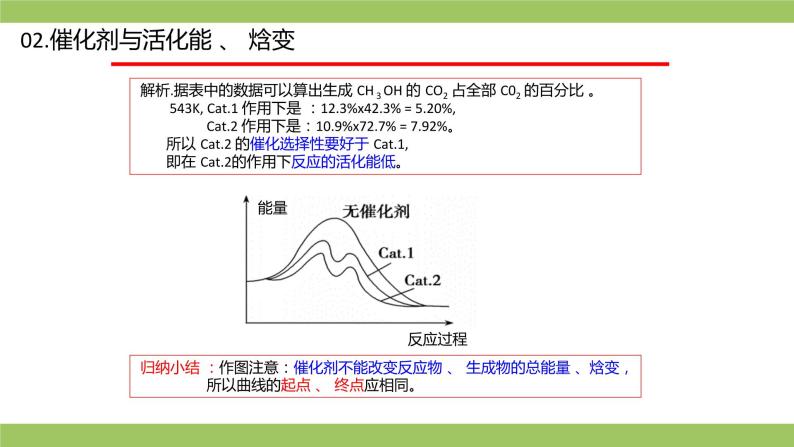
解析.据表中的数据可以算出生成 CH 3 OH 的 CO2 占全部 C02 的百分比 。 543K, Cat.1 作用下是 :12.3%x42.3% = 5.20%, Cat.2 作用下是:10.9%x72.7% = 7.92%。 所以 Cat.2 的催化选择性要好于 Cat.1, 即在 Cat.2的作用下反应的活化能低。
归纳小结 :作图注意:催化剂不能改变反应物 、 生成物的总能量 、焓变, 所以曲线的起点 、 终点应相同。
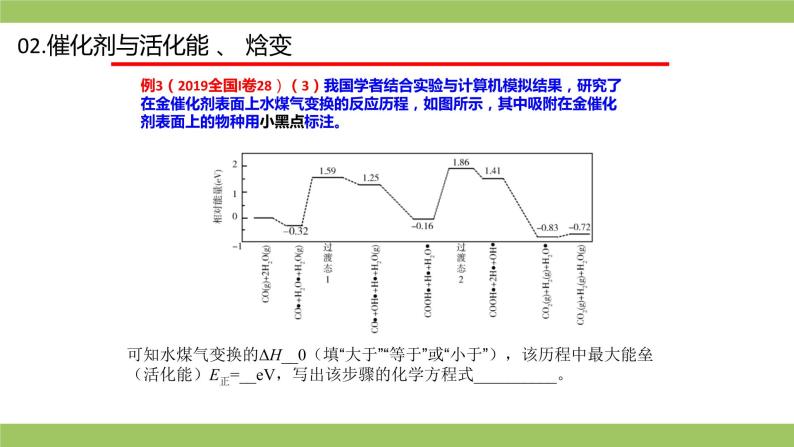
例3(2019全国I卷28)(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用小黑点标注。
可知水煤气变换的ΔH__0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=__eV,写出该步骤的化学方程式__________。
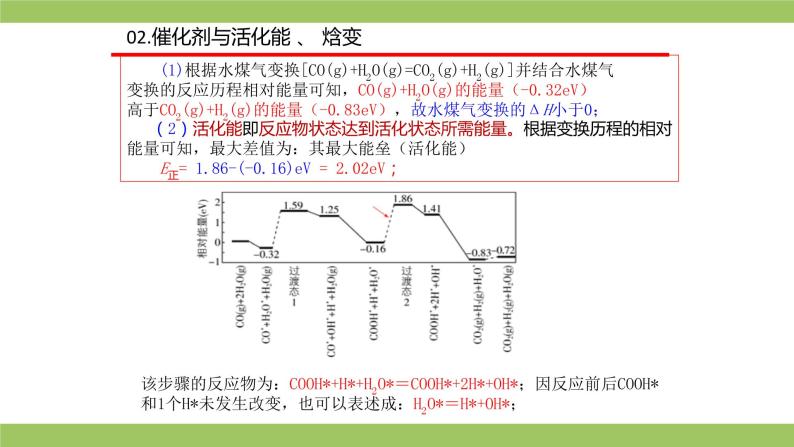
(1)根据水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]并结合水煤气变换的反应历程相对能量可知,CO(g)+H2O(g)的能量(-0.32eV)高于CO2(g)+H2(g)的能量(-0.83eV),故水煤气变换的ΔH小于0; (2)活化能即反应物状态达到活化状态所需能量。根据变换历程的相对能量可知,最大差值为:其最大能垒(活化能) E正= 1.86-(-0.16)eV = 2.02eV;
该步骤的反应物为:COOH*+H*+H2O*=COOH*+2H*+OH*;因反应前后COOH*和1个H*未发生改变,也可以表述成:H2O*=H*+OH*;
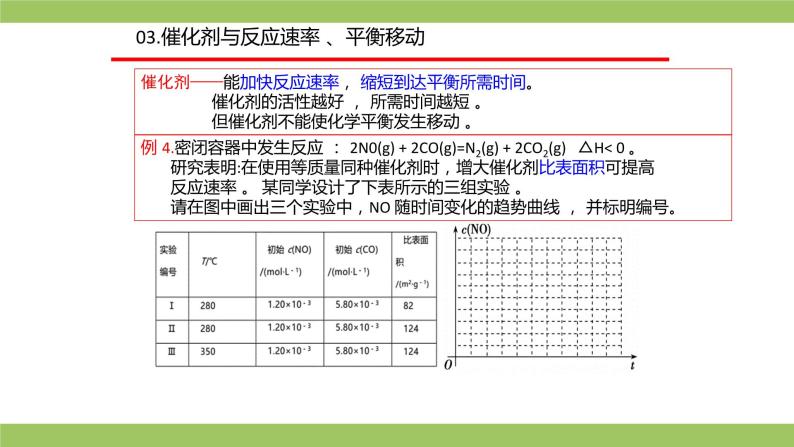
例 4.密闭容器中发生反应 : 2N0(g) + 2CO(g)=N2(g) + 2CO2(g) △H< 0 。 研究表明:在使用等质量同种催化剂时,增大催化剂比表面积可提高 反应速率 。 某同学设计了下表所示的三组实验 。 请在图中画出三个实验中,NO 随时间变化的趋势曲线 , 并标明编号。
03.催化剂与反应速率 、平衡移动
催化剂——能加快反应速率, 缩短到达平衡所需时间。 催化剂的活性越好 , 所需时间越短 。 但催化剂不能使化学平衡发生移动 。
解析:(1)先比较实验Ⅰ 、 Ⅱ : 实验Ⅱ 的催化剂比表面积大 , 故实验 Ⅱ的反应速率大 ; 因催化剂不影响平衡移动 , 故达到平衡后 , 实验Ⅰ 、 Ⅱ的 c(NO) 相同 。 (2)再比较Ⅱ 、 Ⅲ : 实验 Ⅲ 的温度高 , 故实验 Ⅲ 的反应速率大 ; 因温度升高, 平衡左移 ,故平衡时 dNO) 较大。
03.催化剂与反应速率 、 平衡移动
催化剂具有一定范围的活化温度 , 过高或过低 , 都会导致催化剂的活性降低。 如生物催化剂酶 , 对温度就非常敏感 。
04.温度与催化剂活性
例 5.( 2017天津) H2S 和 SO2 会对环境和人体健康带来极大的危害 , 工业上采取多种方法减少这些有害气体的排放生物脱 H2S 的原理为 H2S + Fe2(SO4)3 =S + 2FeSO4 + H2SO4 4FeSO4 + 02 + 2H2SO4 =2Fe2(SO4)3 + 2H2O硫杆菌存在时 , FeSO4 被氧化的速率是无菌时的 5x105 倍 ,该菌的作用是___;若反应温度过高 ,反应速率下降 ,其原因是___________;
解析:反应的催化剂; 催化剂硫杆菌因蛋白质变性而失去了催化性能。
例 6.向三颈烧瓶中加入一定量的 MnO2 和水 , 搅拌 , 通入 SO2 和 N2 混合气体 , 恒温下发生反应 : MnO2 +H2SO3 =MnSO4 +H2O ;若将 N2换成空气 , 测得 C(Mn2+ ) 、 C(SO42—) 随时间 t 的变化如图所示 。 导致 C(Mn2+ ) 、 C(SO42—) 变化产生明显差异的原因是________________;
05.催化剂的来源问题
化学中有一类特殊反应 , 叫自催化反应 , 该类反应中的生成物对反应有催化作用 。 它的特点之一是开始反应速率很小 , 随着起催化作用的产物的积累速率迅速增大 。
解析:由图可知 , "N2 换成空气"发生了副反应 : O2 + 2H2SO3=2H2SO4 表示 C(SO42—) 的曲线斜率逐渐增大 , 说明 SO42— 的生成速率逐渐增大, 因反应物浓度 、 压强 、 温度 、 接触面积等维持不变 , 所以导致 SO42— 的生成速率加快的因素应是催化削 , 而且催化剂是某种生成物 , 应是 Mn2+ [ 答案 ]Mn2+ 对: O2 + 2H2SO3=2H2SO4 的反应有催化作用
归纳小结 : 判断一个化学反应是否是自催化反应 , 先要排除温度 、 浓度 、 压强 、 接触面积等的影响 , 然后再分析是何种生成物具有催化作用。
06.催化剂 、 温度对平衡的综合影响
解析:(1) 先分析催化剂 A 作用下的脱氧率为什么会先增大后减小 ? 低于300°C 时 , 温度越高,反应速率越快,相同时间内消耗的 NO 越多 , 所以脱氮率增大;高于 300°C 时 , 因为温度升高 ,平衡逆向移动,消耗的 NO 减小,所以脱氮率下降。 (2)改用催化剂B,就涉及催化剂和温度两个变量:① B催化下,随着温度的升高, 脱策率也应先增大后减小;②达到曲线最高点之前,B的催化能力弱,相同温 度时的脱氛率要小于 A,即所画曲线应在 A 的下方。③ B催化下在相同时间内 达到平衡,则曲线最高点应出现在高于300°C 的位置。④当 A、B均达到平 衡后,平衡脱氮率只与温度有关,所以两条曲线重合。
概括整合I 催化剂通过参与化学反应, 改变反应历程, 从而降低活化能,加快反应速率,到达平衡所需的时间减少。 但催化剂不能改变焓变, 也不能使平衡移动,催化剂的催化性能也会受外界条件的影响,如温度 、 表面积等。
1.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH<0已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=___,y=___
2.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:第一步 I2(g) 2I(g) (快反应)第二步 I(g)+N2O(g)―→N2(g)+IO(g) (慢反应)第三步 IO(g)+N2O(g)―→N2(g)+O2(g)+I(g)(快反应)实验表明,含碘时N2O的分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是_____(填字母)。A.I2浓度与N2O分解速率无关 B.第二步对总反应速率起决定作用C.第二步活化能比第三步小 D.IO为反应的中间产物
解析 N2O分解反应中,实验表明,含碘时N2O的分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)和碘蒸气浓度有关,故A错误;第二步I(g)+N2O(g)―→N2(g)+IO(g)(慢反应),在整个反应过程中对总反应速率起到决定性作用,故B正确;第二步反应慢说明活化能比第三步大,故C错误。
3.化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB―→cC+dD,其速率方程为v=k·ca(A)·cb(B)(k为只与温度有关的速率常数),复杂反应(由几个基元反应构成)的速率取决于慢的基元反应。(1)已知反应NO2(g)+CO(g) NO(g)+CO2(g) ΔH<0,在温度低于250 ℃时是由两个基元反应构成的复杂反应,该反应的速率方程为v=k·c2(NO2),则其两个基元反应分别为:Ⅰ._______===NO3+_____;Ⅱ.略,这两个反应中活化能较小的是____。
解析 温度低于250 ℃时,该反应的速率方程式为v=k·c2(NO2),说明NO2和CO不参与同一个基元反应,且NO2参与的基元反应为慢反应,决定了该反应的反应速率,基元反应Ⅰ中产物有NO3,根据元素守恒可知该基元反应反应物应为NO2,则该基元反应Ⅰ为:2NO2===NO3+NO; 活化能越大,反应速率越慢,基元反应Ⅰ决定整个反应速率,说明反应Ⅰ活化能较大,即反应Ⅱ活化能较小。
(2)某科研小组测得380 ℃时该反应的c(NO2)、c(CO)与生成CO2的速率[v(CO2)]的关系如下:
则该温度下的反应速率常数k=______L·ml-1·s-1。
解析 根据表格分析可知CO和NO2的浓度均会影响反应速率,由于该反应不是基元反应,由题意可设该反应的正反应速率v=k·c(NO2)·c(CO),将表格中相应数据代入有2.2×10-4 ml·L-1·s-1=k×0.04 ml·L-1× 0.025 ml·L-1,可解得k=0.22 L·ml-1·s-1。
4.(1)温度为T1 ℃时,将等物质的量的CO2和H2充入体积为1 L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) ΔH=-31.4 kJ·ml-1 K=2实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1 ℃时,k逆=______(以k正表示)。
(2)当温度改变为T2 ℃时,k正=1.9k逆,则T2 ℃时平衡压强___T1 ℃时平衡压强(填“>”“<”或“=”),理由是_________________________________________________________________________________________________________________________________。
CO2(g)+H2(g) HCOOH(g)
为放热反应,温度升高,平衡常数减小,平衡左移,气体的物质的量增加,总压强增大;温度升高,总压强增大
2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第2讲 催化剂的反应机理与能垒图像课件PPT: 这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第2讲 催化剂的反应机理与能垒图像课件PPT,共54页。PPT课件主要包含了答案D,答案B,CH3OH,CH3COOH,答案C,答案A等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习:化学反应速率与反应历程(机理)课件: 这是一份2024届高三化学高考备考一轮复习:化学反应速率与反应历程(机理)课件,共47页。PPT课件主要包含了a∶b∶c∶d,③①②⑤④,合适的取向,活化分子,反应物分子等内容,欢迎下载使用。
(新高考)高考化学大一轮复习课件第7章第40讲热点强化12化学反应历程、机理的分析应用(含解析): 这是一份(新高考)高考化学大一轮复习课件第7章第40讲热点强化12化学反应历程、机理的分析应用(含解析),共21页。












