

高中鲁科版第1节 碳的多样性第2课时习题
展开第2课时 碳及其化合物间的转化
课后篇巩固提升
A组 基础巩固
1.地球大气中的CO2、CH4等气体含量上升,会使地球表面温度升高,即产生“温室效应”,下列说法不正确的是 ( )
A.控制温室气体排放,遏制全球变暖趋势是社会可持续发展的保障
B.CH4是目前全球变暖的最主要温室气体
C.大气中CO2含量猛增,会破坏自然界中碳及其化合物的平衡
D.遏制全球变暖趋势的最有效措施是减少使用化石燃料
解析目前导致全球变暖的最主要温室气体是CO2。
答案B
2.对于碳及其化合物间转化的说法中,正确的是( )
A.大气中CO2含量的剧增,对自然界中碳及其化合物间的平衡没有影响
B.木炭燃烧过程中,存在碳单质、CO和CO2之间的转化
C.碳的氧化物间的相互转化不属于氧化还原反应
D.含碳的无机化合物和有机化合物之间存在着严格的界限,无机化合物不能合成有机化合物
答案B
3.要除去CO2气体中的CO,常用的方法是( )
A.通过澄清石灰水
B.通过燃烧的炭层
C.通过水
D.通过灼热的CuO粉末
解析CO不同于CO2的性质是它具有还原性,要除去CO应选氧化性的物质与之反应,将其耗尽,CuO具有氧化性,且反应后会生成CO2。
答案D
4.将CO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是( )
A.硫酸氢钾溶液 B.碳酸氢钙溶液
C.氯水 D.氢氧化钠溶液
解析只有将CO2通入碱性溶液中,才能生成C,并与Ca2+结合形成CaCO3沉淀;而A、C项中的溶液均显酸性,不能形成C;碳酸氢钙中虽然有大量的Ca2+和HC,但C的量仍然很少,无法形成CaCO3沉淀。
答案D
5.无色气体X与灼热的炭反应得到一种无色气体Y,Y与灼热的氧化铜反应又得到无色气体X,则X、Y分别是 ( )
A.O2、CO2 B.CO2、CO
C.CO、CO2 D.O2、CO
解析根据无色气体X和灼热的炭反应生成的无色气体Y能与灼热的氧化铜反应,则Y不可能是O2,也不会是CO2,从而可确定Y是CO,再由X+CCO可推出X是CO2。
答案B
6.向Na2CO3溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则该过程中,溶液中的HC浓度变化趋势为( )
A.逐渐减小
B.先逐渐增大,而后减小
C.逐渐增大
D.先逐渐减小,而后增大
解析首先发生反应C+H+HC,所以溶液中HC的浓度逐渐增大,当所有的C转化为HC后,又发生反应HC+H+H2O+CO2↑,所以溶液中HC的浓度又减小。
答案B
7.导学号50534098可以说明溶液中大量存在C的理由是( )
A.加入AgNO3溶液有白色沉淀产生
B.加入盐酸有无色无味气体产生
C.加入MgCl2时有白色沉淀产生,再加稀盐酸,沉淀溶解,放出使澄清石灰水变浑浊的无色气体
D.加入Ba(OH)2溶液有白色沉淀产生,再加入稀盐酸,沉淀溶解,且产生可使澄清石灰水变浑浊的无色气体
解析与AgNO3溶液反应能生成白色沉淀的有Cl-、S、C等离子,A不能证明;B、D选项中HC也会产生同样现象;C项可以排除HC的干扰,HC与Mg2+不会生成沉淀,所以应选C。
答案C
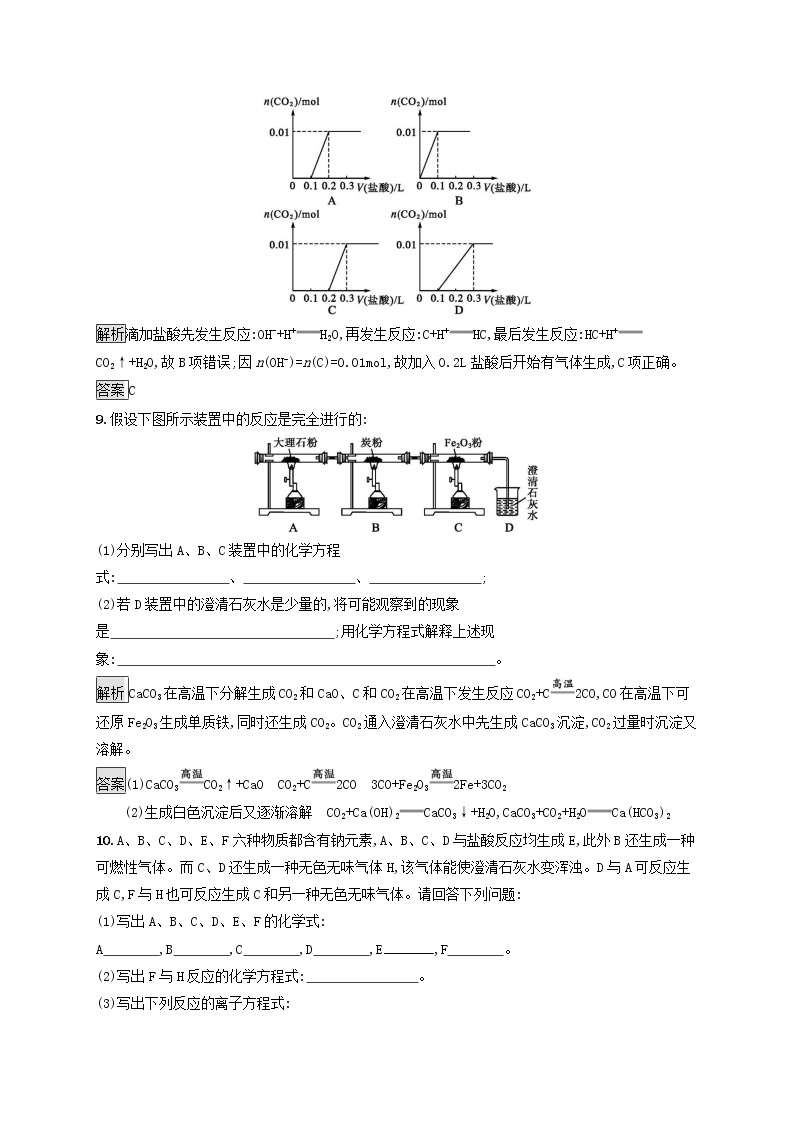
8.导学号50534099将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
解析滴加盐酸先发生反应:OH-+H+H2O,再发生反应:C+H+HC,最后发生反应:HC+H+CO2↑+H2O,故B项错误;因n(OH-)=n(C)=0.01mol,故加入0.2L盐酸后开始有气体生成,C项正确。
答案C
9.假设下图所示装置中的反应是完全进行的:
(1)分别写出A、B、C装置中的化学方程式: 、 、 ;
(2)若D装置中的澄清石灰水是少量的,将可能观察到的现象是 ;用化学方程式解释上述现象: 。
解析CaCO3在高温下分解生成CO2和CaO、C和CO2在高温下发生反应CO2+C2CO,CO在高温下可还原Fe2O3生成单质铁,同时还生成CO2。CO2通入澄清石灰水中先生成CaCO3沉淀,CO2过量时沉淀又溶解。
答案(1)CaCO3CO2↑+CaO CO2+C2CO 3CO+Fe2O32Fe+3CO2
(2)生成白色沉淀后又逐渐溶解 CO2+Ca(OH)2CaCO3↓+H2O,CaCO3+CO2+H2OCa(HCO3)2
10.A、B、C、D、E、F六种物质都含有钠元素,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D与A可反应生成C,F与H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式:
A ,B ,C ,D ,E,F 。
(2)写出F与H反应的化学方程式: 。
(3)写出下列反应的离子方程式:
①D+盐酸 。
②B+水 。
解析能使澄清石灰水变浑浊的气体H是CO2,钠的化合物与盐酸反应生成的是NaCl,故E为NaCl;C、D与盐酸反应除生成NaCl外,还生成CO2,故C、D为Na2CO3和NaHCO3,又知D与A可生成C,则D为NaHCO3,A为NaOH;F与CO2生成Na2CO3和一种气体,可知F为Na2O2,B与盐酸生成NaCl和可燃性气体,知B为Na。
答案(1)NaOH Na Na2CO3 NaHCO3 NaCl Na2O2
(2)2Na2O2+2CO22Na2CO3+O2
(3)①HC+H+H2O+CO2↑
②2Na+2H2O2Na++2OH-+H2↑
11.为探究CO2与NaOH溶液发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,如下图所示,请回答下列问题:
(1)请写出CO2与足量NaOH溶液发生反应的离子方程式: 。
(2)选择任意一种实验装置,简述预计出现的实验现象,并解释产生该实验现象的原因。你选择的实验装置是 ,实验现象是 ,产生该实验现象的原因是 。
解析(1)CO2与足量NaOH溶液发生的反应为CO2+2NaOHNa2CO3+H2O,将此化学方程式改写为离子方程式即可;(2)甲、乙、丙三个实验均是利用CO2与NaOH反应后,导致装置内压强减小,而发生一系列现象。
答案(1)CO2+2OH-C+H2O
(2)甲 试管内液面上升,烧杯内的液面下降 二氧化碳与氢氧化钠溶液反应,使试管内气体压强减小,液体被压入试管中(或乙 气球胀大 二氧化碳与氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大或丙 烧杯内的水流入锥形瓶中 二氧化碳与氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将液体压入锥形瓶)
B组 能力提升
1.下列是某兴趣小组根据教材实验设计的一个能说明Na2CO3和NaHCO3热稳定性的套管实验。请观察如图所示实验装置并研究实验原理,其中分析错误的是 ( )
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
D.加热不久就能看到A烧杯的澄清石灰水变浑浊
解析要判断碳酸氢钠和碳酸钠的热稳定性,则碳酸氢钠在小试管,碳酸钠在大试管,大试管直接加热,温度较高,如温度较高的不分解,而加热温度较低的物质分解,即可判断稳定性强弱,故甲为碳酸氢钠、乙为碳酸钠,A正确;白色的无水硫酸铜遇到水显示蓝色,可证明碳酸氢钠受热能产生水,因此在小试管内塞上沾有无水硫酸铜粉末的棉花球,如果变蓝则可证明碳酸氢钠受热能产生水,B正确;碳酸钠较稳定,加热过程中不会分解,则连接A烧杯的试管中不会产生二氧化碳,所以A烧杯的澄清石灰水不会变浑浊,C正确,D错误。
答案D
2.120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.0.18 mol·L-1 D.0.24 mol·L-1
解析若碳酸钠恰好与盐酸反应生成碳酸氢钠,则盐酸的浓度为1.0mol·L-1;若碳酸钠恰好与盐酸反应生成二氧化碳,则盐酸的浓度是2.0mol·L-1。由于最终生成的气体体积不同,所以只能是介于二者之间。
答案B
3.已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
饱和NaCl(溶液)NaHCO3Na2CO3
这种方法被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气。
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式: 。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去? (写出方法);如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去? (写出化学方程式)。
(3)某课外活动小组,接受实验室的任务,用Na2CO3制取NaOH固体,提供的原料只有纯碱和石灰石。请将你的实验方案用流程图表示出来: 。
解析除去Na2CO3固体中的NaHCO3,可用加热的方法使NaHCO3分解生成Na2CO3;除去NaHCO3溶液中的Na2CO3,可通入CO2,将Na2CO3转化为NaHCO3。实验室制取NaOH,可用Na2CO3溶液和Ca(OH)2溶液反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOH,过滤可得NaOH溶液,然后蒸干可得NaOH固体。
答案(1)2NaHCO3Na2CO3+H2O+CO2↑
(2)加热 Na2CO3+H2O+CO22NaHCO3
(3)石灰石氧化钙氢氧化钙氢氧化钠溶液氢氧化钠固体
4.将一定体积的CO2通入一定浓度的NaOH溶液中,为了测定反应后所得溶液的成分,向该溶液中逐滴加入1 mol·L-1的盐酸。所加入盐酸的体积与产生二氧化碳气体体积(标准状况)的关系如图所示。
(1)写出OA段所发生反应的离子方程式: 。
(2)当加入35 mL盐酸时,所产生的二氧化碳的体积(标准状况)是 mL。
(3)溶液中所含的溶质有 ,其物质的量之比为 。
解析由图像所示消耗的盐酸的体积和产生的CO2的体积间的关系可知,此溶液的溶质是NaOH、Na2CO3。OA段H+先与OH-反应生成H2O,再与C反应生成HC。AB段发生反应的离子方程式为H++HCCO2↑+H2O,当加入35mL盐酸时产生的n(CO2)=(35-25)×10-3L×1mol·L-1=0.01mol,则V(CO2)=224mL。由H++CHC,HC+H+H2O+CO2↑,知n(C)=nAB(H+)=(45-25)×10-3L×1mol·L-1=0.02mol,n(OH-)=[25-(45-25)]×10-3L×1mol·L-1=0.005mol,所以n(NaOH)∶n(Na2CO3)=n(OH-)∶n(C)=0.005mol∶0.02mol=1∶4。
答案(1)H++OH-H2O、C+H+HC
(2)224
(3)NaOH、Na2CO3 1∶4
高中鲁科版第4节 海水中的化学元素第2课时随堂练习题: 这是一份高中鲁科版第4节 海水中的化学元素第2课时随堂练习题,共7页。试卷主要包含了能使淀粉碘化钾溶液变蓝的是,将KCl和KBr的混合物13等内容,欢迎下载使用。
鲁科版必修1第3节 硫的转化第2课时课时训练: 这是一份鲁科版必修1第3节 硫的转化第2课时课时训练,共7页。试卷主要包含了可以用浓硫酸干燥的气体是,45 ml,在通常情况下,A是固体单质等内容,欢迎下载使用。
高中化学鲁科版必修1第4节 海水中的化学元素第1课时课时练习: 这是一份高中化学鲁科版必修1第4节 海水中的化学元素第1课时课时练习,共4页。试卷主要包含了100L×2ml·L-1=0等内容,欢迎下载使用。













