化学选择性必修1第三单元 盐类的水解课后作业题
展开A.CO eq \\al(\s\up1(2-),\s\d1(3)) B.HCO eq \\al(\s\up1(-),\s\d1(3))
C.Na+D.NH eq \\al(\s\up1(+),\s\d1(4))
2.下列离子方程式属于盐的水解,且书写正确的是( )
A.FeCl3溶液:Fe3++3H2O⇌Fe(OH)3↓+3H+
B.NaHS溶液:HS-+H2O⇌S2-+H3O+
C.Na2SO3溶液:SO eq \\al(\s\up1(2-),\s\d1(3)) +2H2O⇌H2SO3+2OH-
D.NH4Cl溶液:NH eq \\al(\s\up1(+),\s\d1(4)) +H2O⇌NH3·H2O+H+
3.下列各微粒中,能使水的电离平衡向电离的方向移动,且使溶液的pH<7的是( )
A.26M3+B.HCO eq \\al(\s\up1(-),\s\d1(3))
C.HSO eq \\al(\s\up1(-),\s\d1(4)) D.
4.某酸式盐NaHY的水溶液中c(OH-)>c(H+),则下列叙述正确的是( )
A.H2Y的电离方程式:H2Y⇌2H++Y2-
B.HY-的水解离子方程式:HY-+H2O⇌H3O++Y2-
C.该溶液中:c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+)
D.该溶液中:c(Na+)>c(Y2-)>c(HY-)
5.常温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为aml·L-1与bml·L-1,则a和b关系为( )
A.a>bB.a=10-4b
C.b=10-4aD.a=b
6.要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.丁学生:在醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的
B.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
C.乙学生:在盐酸中加入同温度的氨水,若混合液温度下降,说明盐类水解是吸热的
D.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
7.由一价离子组成的四种盐(AC、BD、AD、BC)溶液的浓度均为1ml·L-1,在室温下前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则( )
8.一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断一定正确的是( )
A.c(A-)≥c(M+)
B.c(A-)=c(M+)
C.若MA不水解,则c(OH-)
9.在相同的条件下测得①NaCN ②CH3COONa ③NaClO三种溶液pH相同,并且Ka(CH3COOH)>Ka(HClO)>Ka(HCN),则它们的物质的量浓度的大小顺序是( )
A.①>②>③B.②>①>③
C.②>③>①D.③>①>②
10.下列判断正确的是________(填序号)。
①0.1ml·L-1的一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O===HA+OH-
②向Na2CO3溶液中滴入酚酞溶液,溶液变红色的原因是CO eq \\al(\s\up1(2-),\s\d1(3)) +H2O===HCO eq \\al(\s\up1(-),\s\d1(3)) +OH-
③NaHSO3溶于水显酸性是因为HSO eq \\al(\s\up1(-),\s\d1(3)) 的水解程度HSO eq \\al(\s\up1(-),\s\d1(3)) +H2O⇌H2SO3+OH-小于其电离程度HSO eq \\al(\s\up1(-),\s\d1(3)) ⇌SOeq \\al(\s\up1(2-),\s\d1(3))+H+
④NaHS溶于水显碱性是因为HS-的水解程度HS-+H2O⇌H2S+OH-大于其电离程度HS-⇌H++S2-
⑤KAl(SO4)2·12H2O溶于水具有净水作用是因为Al3++3H2O===Al(OH3)↓+3H+
⑥Na2S溶于水显碱性是因为S2-+2H2O⇌H2S+2OH-
⑦常温下,1L1ml·L-1NaHCO3溶液中含有的HCO eq \\al(\s\up1(-),\s\d1(3)) 和H2CO3分子共1ml
11.现有S2-、SO eq \\al(\s\up1(2-),\s\d1(3)) 、NH eq \\al(\s\up1(+),\s\d1(4)) 、Al3+、HPO eq \\al(\s\up1(2-),\s\d1(4)) 、Na+、SO eq \\al(\s\up1(2-),\s\d1(4)) 、AlO eq \\al(\s\up1(-),\s\d1(2)) 、Fe3+、HCO eq \\al(\s\up1(-),\s\d1(3)) 、Cl-,请按要求填空:
(1)在水溶液中,水解后溶液呈碱性的离子是________________________________________________________________________。
(2)在水溶液中,水解后溶液呈酸性的离子是________________________________________________________________________。
(3)既能在酸性较强的溶液中大量存在,又能在碱性较强的溶液中大量存在的离子有________________________________________________________________________。
(4)既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在的离子有________________________________________________________________________。
12.现有下列电解质溶液:
①Na2CO3 ②NaHCO3 ③
④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)________。
(2)已知酸性:H2CO3>>HCO eq \\al(\s\up1(-),\s\d1(3)) 。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式:________________________________________________________________________。
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH________7(填“>”“=”或“<”),理由是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
13.在室温下,下列五种溶液:①0.1ml·L-1NH4Cl溶液 ②0.1ml·L-1CH3COONH4溶液 ③0.1ml·L-1NH4HSO4溶液 ④0.1ml·L-1NH3·H2O和0.1ml·L-1NH4Cl混合液 ⑤0.1ml·L-1氨水
请根据要求填写下列空白:
(1)溶液①呈________(填“酸”“碱”或“中”)性,其原因是______________________________(用离子方程式表示)。
(2)溶液②③中c(NH eq \\al(\s\up1(+),\s\d1(4)) )的大小关系是②________(填“>”“<”或“=”)③。
(3)在溶液④中________(离子)的浓度为0.1ml/L;NH3·H2O和________(离子)的浓度之和为0.2ml/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”“<”或“=”,下同)NH eq \\al(\s\up1(+),\s\d1(4)) 的水解程度,CH3COO-与NH eq \\al(\s\up1(+),\s\d1(4)) 浓度的大小关系是c(CH3COO-)________c(NH eq \\al(\s\up1(+),\s\d1(4)) )。
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:________________________________________________________________________
________________________________________________________________________。
②若溶液M由10mL2ml·L-1NaHA溶液与10mL2ml·L-1NaOH溶液混合而得,则溶液M的pH________(填“>”“<”或“=”)7。
14.某盐或“类盐”的化学式为XmYn(最简结构),将一定量的该盐溶于足量的水时:
(1)若m≠n,测得溶液的pH为5,则该盐与水反应的离子方程式可能为________________________________________________________________________。
(2)若m≠n,测得该盐溶液的pH为9,则该盐与水反应的离子方程式可能为________________________________________________________________________。
(3)若m≠n,X、Y为同周期的短周期元素,XmYn溶于水时,既有白色沉淀,又有无色气体放出,则溶于水的化学方程式为________________________________________________________________________。
(4)若m≠n,X、Y为不同周期的短周期元素,XmYn溶于水时,既有白色沉淀,又有无色气体放出,则溶于水的化学方程式为________________________________________________________________________。
(5)若X、Y为同主族元素,且m=n,则该物质溶于水的化学方程式为________________________________________________________________________。
溶于水后溶液呈碱性,如________;溶于水后溶液呈酸性,如________。
15.25℃时,如果将0.1ml·L-1HA溶液与0.1ml·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:________________________________________________________________________
________________________________________________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)水________(填“<”“>”或“=”)0.1ml·L-1NaOH溶液中由水电离出的c(H+)水。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”)。
(4)将相同温度下相同浓度的五种溶液:
①(NH4)2CO3 ②NH3·H2O ③(NH4)2SO4
④NH4Cl ⑤CH3COONH4。
按c(NH eq \\al(\s\up1(+),\s\d1(4)) )由大到小的顺序排列:________________________________________________________________________
(填序号)。
课时作业16 盐类的水解原理
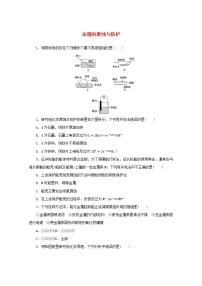
1.解析:由题给水解过程示意图可知X带一个单位正电荷,再根据右侧的结构模型可判断出X为NH eq \\al(\s\up1(+),\s\d1(4)) 。
答案:D
2.答案:D
3.解析:首先判断A、D项的微粒分别是Fe3+、S2-。Fe3+能结合水电离出来的OH-,使水的电离平衡向电离的方向移动,并且使溶液呈酸性,pH<7,A项符合题意;HCO eq \\al(\s\up1(-),\s\d1(3)) 结合水电离出的H+促进水的电离,溶液呈碱性,pH>7,B项不符合题意;HSO eq \\al(\s\up1(-),\s\d1(4)) 能完全电离出H+,使溶液呈酸性,pH<7,但抑制了水的电离,C项不符合题意;S2-水解显碱性,D错误。
答案:A
4.解析:由溶液呈碱性可知,H2Y是多元弱酸,电离方程式应分步书写,A项错误;HY-水解生成H2Y,HY-+H2O⇌H2Y+OH-,B项错误;溶液中存在NaHY===Na++HY-,HY-⇌Y2-+H+,HY-+H2O⇌H2Y+OH-,H2O⇌H++OH-,但HY-的电离和水解是微弱的,故c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+),C项正确;根据溶液中c(OH-)>c(H+)知,HY-的水解程度大于其电离程度,故c(Na+)>c(HY-)>c(H2Y)>c(Y2-),D项错误。
答案:C
5.解析:NaOH抑制水的电离,所以由水电离出的c(OH-)等于溶液中的c(H+)等于10-9ml·L-1。CH3COONa水解,促进了水的电离,所以由水电离出的c(OH-)=(10-14÷10-9)ml·L-1=10-5ml·L-1,故eq \f(a,b)=eq \f(10-9,10-5)=10-4,即a=10-4b。
答案:B
6.答案:A
7.解析:由A、D溶液的pH>7,可知AOH的电离程度大于HD。由B、C溶液的pH<7,可知BOH的电离程度小于HC。同理由A、C、B、D溶液的pH=7,可知AOH与HC、BOH与HD的电离程度相同。故有电离程度:HC=AOH>HD=BOH,即HC的酸性大于HD,AOH的碱性大于BOH。
答案:A
8.解析:若MA不水解,溶液呈中性,c(OH-)=c(H+),根据电荷守恒,c(A-)=c(M+);若MA水解,说明HA为弱酸,则MA溶液中c(OH-)>c(H+),根据电荷守恒,c(A-)
9.解析:当三种盐溶液浓度相同时,其水解程度的大小顺序为①>③>②,根据越弱越水解,三种溶液的pH由大到小的顺序为①>③>②,所以,当三者溶液pH相同时,水解程度较小的浓度则应较大。
答案:C
10.答案:③④
11.解析:(1)弱酸根离子水解后溶液显碱性,部分酸式酸根离子若其水解程度大于电离程度,则溶液也显碱性,即S2-、SO eq \\al(\s\up1(2-),\s\d1(3)) 、HPO eq \\al(\s\up1(2-),\s\d1(4)) 、AlO eq \\al(\s\up1(-),\s\d1(2)) 、HCO eq \\al(\s\up1(-),\s\d1(3)) 水解后溶液呈碱性。
(2)NH eq \\al(\s\up1(+),\s\d1(4)) 、Al3+、Fe3+属于弱碱的阳离子,水解后溶液呈酸性。
(3)Na+是强碱的阳离子,Cl-和SO eq \\al(\s\up1(2-),\s\d1(4)) 是强酸的阴离子,它们既能在强酸性溶液中存在又能在强碱性溶液中存在。
(4)HPO eq \\al(\s\up1(2-),\s\d1(4)) 、HCO eq \\al(\s\up1(-),\s\d1(3)) 既能与强酸反应,又能与强碱反应。
答案:(1)S2-、SO eq \\al(\s\up1(2-),\s\d1(3)) 、HPO eq \\al(\s\up1(2-),\s\d1(4)) 、AlO eq \\al(\s\up1(-),\s\d1(2)) 、HCO eq \\al(\s\up1(-),\s\d1(3))
(2)NH eq \\al(\s\up1(+),\s\d1(4)) 、Al3+、Fe3+
(3)Na+、Cl-、SO eq \\al(\s\up1(2-),\s\d1(4))
(4)HPO eq \\al(\s\up1(2-),\s\d1(4)) 、HCO eq \\al(\s\up1(-),\s\d1(3))
12.解析:(1)五种电解质溶液中,NaHCO3、CH3COONH4、NH4HCO3既能结合H+又能结合OH-,所以既能与盐酸又能与烧碱溶液反应。
(2)根据酸性强弱关系可知HCO eq \\al(\s\up1(-),\s\d1(3)) 、、CO eq \\al(\s\up1(2-),\s\d1(3)) 的水解程度由大到小的顺序为CO eq \\al(\s\up1(2-),\s\d1(3)) >>HCO eq \\al(\s\up1(-),\s\d1(3)) ,溶液pH由大到小的顺序为①>③>②。
(3)NH4HCO3与足量NaOH溶液混合加热反应的离子方程式为NH eq \\al(\s\up1(+),\s\d1(4)) +HCO eq \\al(\s\up1(-),\s\d1(3)) +2OH-eq \(=====,\s\up7(△))NH3↑+CO eq \\al(\s\up1(2-),\s\d1(3)) +2H2O。
(4)若常温下CH3COONH4溶液呈中性,说明CH3COO-和NH eq \\al(\s\up1(+),\s\d1(4)) 水解程度相同,而H2CO3酸性弱于CH3COOH,所以HCO eq \\al(\s\up1(-),\s\d1(3)) 的水解程度大于CH3COO-,因此NH4HCO3溶液的pH>7。
答案:(1)②④⑤
(2)① ③ ②
(3)NH eq \\al(\s\up1(+),\s\d1(4)) +HCO eq \\al(\s\up1(-),\s\d1(3)) +2OH-eq \(=====,\s\up7(△))NH3↑+CO eq \\al(\s\up1(2-),\s\d1(3)) +2H2O
(4)> CH3COONH4溶液呈中性,说明CH3COO-和NH eq \\al(\s\up1(+),\s\d1(4)) 水解程度相同;而H2CO3酸性弱于CH3COOH,所以HCO eq \\al(\s\up1(-),\s\d1(3)) 的水解程度大于CH3COO-,因此NH4HCO3溶液的pH>7
13.解析:(1)NH4Cl为强酸弱碱盐,根据“谁弱谁水解,谁强显谁性”的原则,NH4Cl溶液显酸性。(2)CH3COONH4溶液中,醋酸根离子促进铵根离子的水解,而NH4HSO4溶液中NH4HSO4电离出来的氢离子抑制铵根离子的水解,所以后者中铵根离子浓度大。(3)因为氯离子在溶液中不变化,所以其浓度为0.1ml/L;根据原子守恒可知,含N原子微粒的总物质的量浓度为0.2ml/L,而N原子的存在形式为NH3·H2O和NH eq \\al(\s\up1(+),\s\d1(4)) 。(4)溶液②的pH=7,说明CH3COO-水解生成的OH-的物质的量等于NH eq \\al(\s\up1(+),\s\d1(4)) 水解生成的H+的物质的量,即二者水解程度相同;根据电荷守恒得:c(CH3COO-)+c(OH-)=c(NH eq \\al(\s\up1(+),\s\d1(4)) )+c(H+),因为c(H+)=c(OH-),故c(CH3COO-)=c(NH eq \\al(\s\up1(+),\s\d1(4)) )。(5)①由溶液中存在的微粒可知,H2A为二元弱酸,分步电离。②NaHA和NaOH恰好反应生成Na2A,溶液显碱性。
答案:(1)酸 NH eq \\al(\s\up1(+),\s\d1(4)) +H2O⇌NH3·H2O+H+ (2)< (3)Cl- NH eq \\al(\s\up1(+),\s\d1(4)) (4)= =
(5)①H2A⇌H++HA-,HA-⇌H++A2- ②>
14.解析:盐在水中能完全电离:XmYn===mXn++nYm-。
(1)溶液的pH=5,说明该盐为强酸弱碱盐,因此发生水解:Xn++nH2O⇌X(OH)n+nH+。
(2)溶液的pH=9,说明该盐为强碱弱酸盐,因此发生水解:Ym-+H2O⇌HY(m-1)-+OH-。
(3)据有关现象可知盐溶于水时能发生水解且相互促进。因为X、Y为同周期的短周期元素,且能完全水解,因此该盐为硫化铝,水解方程式为:Al2S3+6H2O===2Al(OH)3↓+3H2S↑。
(4)X、Y为不同周期的短周期元素,“类盐”有氮化镁、碳化铝等,溶于水发生水解反应:Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑、Al4C3+12H2O===4Al(OH)3↓+3CH4↑。
(5)X、Y为同主族元素,且m=n,符合条件的有NaH、KH、BrCl、IBr,水解反应方程式分别为:NaH+H2O===NaOH+H2↑、KH+H2O===KOH+H2↑、BrCl+H2O===HBrO+HCl、IBr+H2O===HIO+HBr。
答案:(1)Xn++nH2O⇌X(OH)n+nH+
(2)Ym-+H2O⇌HY(m-1)-+OH-
(3)Al2S3+6H2O===2Al(OH)3↓+3H2S↑
(4)Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑或Al4C3+12H2O===4Al(OH)3↓+3CH4↑
(5)NaH+H2O===NaOH+H2↑或KH+H2O===KOH+H2↑或BrCl+H2O===HBrO+HCl或IBr+H2O===HIO+HBr NaH、KH BrCl、IBr
15.解析:(1)等量的HA与NaOH混合,恰好完全反应生成盐NaA,由于溶液显碱性,说明NaA是强碱弱酸盐,A-发生了水解。
(2)由于生成的盐NaA能水解,所以促进了水的电离,而NaOH抑制水的电离。
(3)由NH4A溶液为中性可知,HA的电离程度与NH3·H2O的电离程度相同,又由HA溶液加到Na2CO3溶液中有气体放出可知,HA的电离程度大于H2CO3,所以NH3·H2O的电离程度大于H2CO3的,所以(NH4)2CO3溶液显碱性(“谁强显谁性”)。
(4)假设盐未水解,①=③>④=⑤>②;由于①的水解程度大于③,所以c(NH eq \\al(\s\up1(+),\s\d1(4)) ):③>①;由于④的水解程度小于⑤,所以c(NH eq \\al(\s\up1(+),\s\d1(4)) ):④>⑤。
答案:(1)A-+H2O⇌HA+OH-
(2)> (3)>
(4)③>①>④>⑤>②选项
A
B
C
D
碱性
AOH>BOH
AOH
AOH
HC>HD
HC>HD
HC
苏教版 (2019)选择性必修1第三单元 盐类的水解同步训练题: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解同步训练题,共6页。试卷主要包含了解析等内容,欢迎下载使用。
化学第三单元 盐类的水解精练: 这是一份化学第三单元 盐类的水解精练,共9页。试卷主要包含了解析等内容,欢迎下载使用。
化学选择性必修1第二单元 溶液的酸碱性课时作业: 这是一份化学选择性必修1第二单元 溶液的酸碱性课时作业,共11页。试卷主要包含了已知pOH=-lgc,解析等内容,欢迎下载使用。