
2021-2022学年度高中化学期中考试卷-62daf0ec78c0402496f797bf84cb80fd教案
展开考试范围:xxx;考试时间:100分钟;命题人:xxx
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
请点击修改第I卷的文字说明
一、单选题
1.下列离子方程式书写正确的是
A.次氯酸钙溶液中通入过量的CO2:Ca2++2ClO-+H2O+CO 2=CaCO3↓+ 2HClO
B.用石灰乳制漂白粉:2OH-+Cl2=Cl-+ClO-+H2O
C.Ba(OH)2溶液和NaHSO4溶液混合使溶液显中性:2H+++Ba 2++2OH-=2H2O+BaSO4↓
D.氯气通入水中:Cl2+H2O=2H++Cl-+ClO-
2.图示与内容不符合的是
A.AB.BC.CD.D
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题
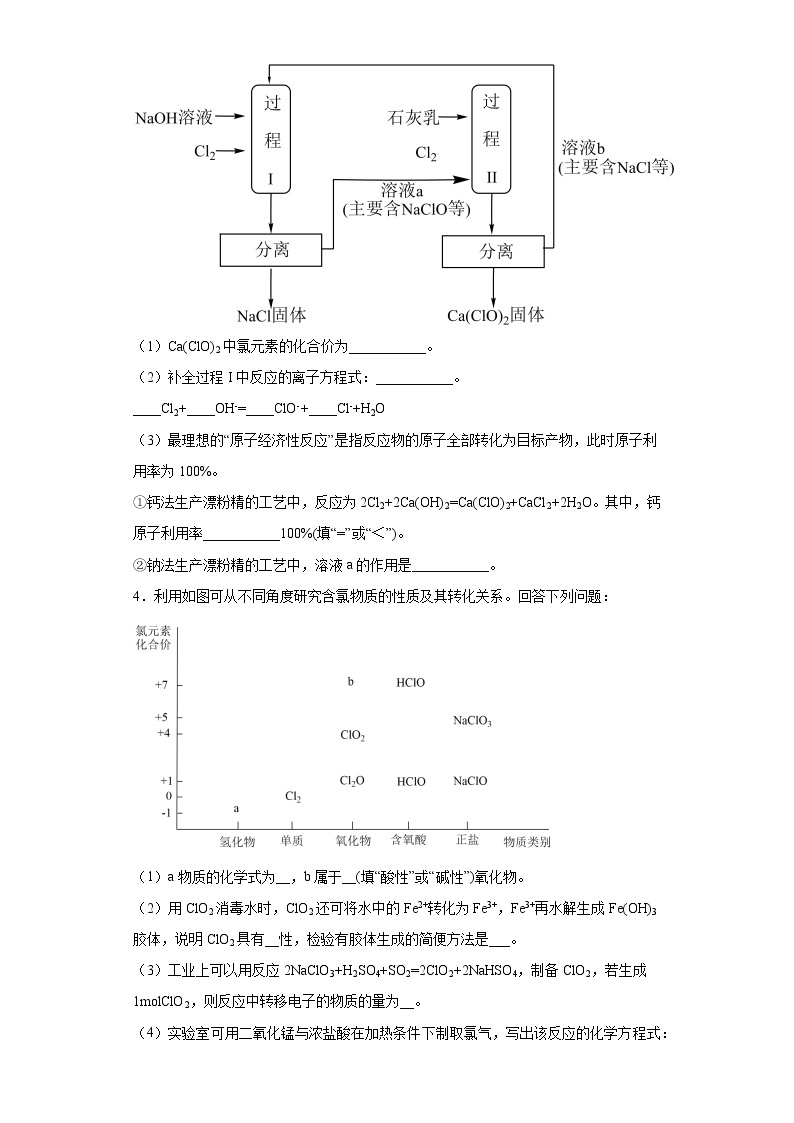
3.漂粉精[主要成分为Ca(ClO)2]是常用消毒剂。下图是钠法生产漂粉精的一种工艺。
(1)Ca(ClO)2中氯元素的化合价为___________。
(2)补全过程I中反应的离子方程式:___________。____Cl2+____OH-=____ClO-+____Cl-+H2O
(3)最理想的“原子经济性反应”是指反应物的原子全部转化为目标产物,此时原子利用率为100%。
①钙法生产漂粉精的工艺中,反应为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O。其中,钙原子利用率___________100%(填“=”或“<”)。
②钠法生产漂粉精的工艺中,溶液a的作用是___________。
4.利用如图可从不同角度研究含氯物质的性质及其转化关系。回答下列问题:
(1)a物质的化学式为__,b属于__(填“酸性”或“碱性”)氧化物。
(2)用ClO2消毒水时,ClO2还可将水中的Fe2+转化为Fe3+,Fe3+再水解生成Fe(OH)3胶体,说明ClO2具有__性,检验有胶体生成的简便方法是___。
(3)工业上可以用反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,制备ClO2,若生成1mlClO2,则反应中转移电子的物质的量为__。
(4)实验室可用二氧化锰与浓盐酸在加热条件下制取氯气,写出该反应的化学方程式:__。
①浓盐酸在该反应中体现的性质有__(填字母)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.2mlCl2,需消耗MnO2的质量为__g。
A
B
C
D
扇闻氯气的气味
用排水法收集氯气
盛装液氯的容器上所贴的标签
证明氯气可以与NaOH溶液反应
参考答案
1.C
【详解】
A.次氯酸钙溶液中通入过量的CO2生成Ca(HCO3)2,离子方程式为ClO-+CO2+H2O=HClO+,A错误;
B.石灰乳需写成Ca(OH)2的形式,不能拆,离子方程式为2Cl2+2Ca(OH)2═2Ca2++2Cl-+2ClO-+2H2O,B错误;
C.溶液显中性说明H+和OH-能完全反应,即Ba(OH)2与NaHSO4为1:2,离子方程式为2H+++Ba2++2OH-=2H2O+BaSO4↓,C正确;
D.Cl2与H2O的反应为可逆反应,且HClO为弱酸,不能拆,离子方程式为Cl2+H2OH++Cl-+HClO,D错误;
故选C。
2.B
【详解】
A.闻氯气的气味时,用手在集气瓶口轻轻扇动,仅使极少量的氯气飘进鼻孔,故不选A;
B.排液法收集气体,应“短进长出”,氯气能溶于水,不能用排水法收集氯气,故选B;
C.氯气有毒,盛装液氯的容器上所贴的标签为剧毒品,故不选C;
D.滴入氢氧化钠溶液,若气球膨胀,则证明氯气可以与NaOH溶液反应,故不选D;
选B。
3.
(1)+1价
(2)Cl2+2OH-=ClO-+Cl-+H2O
(3) < 将Ca(OH)2更多地转化为Ca(ClO)2,提高了钙原子利用率
【分析】
过程I中氯气和氢氧化钠反应生成氯化钠和次氯酸钠,过程II中氯气和石灰乳生成氯化钙和次氯酸钙,过程I中分离得到的次氯酸钠和过程II中Ca(OH)2生成更多的次氯酸钙,过程II中分离后得到的氯化钠溶液加入过程I中,最后得到氯化钠固体。
(1)
Ca(ClO)2中Ca为+2价,O为-2价,故Cl为+1价。
(2)
Cl2中Cl为0价,生成Cl-降低了1价,生成ClO-升高了1价,故根据得失电子守恒,Cl-配系数1,ClO-配系数1,再根据原子守恒,配平得Cl2+2OH-=ClO-+Cl-+H2O。
(3)
①漂粉精的成分为Ca(ClO)2,反应中Ca(OH)2中的Ca除生成了Ca(ClO)2外还生成了CaCl2,故钙原子利用率<100%。
②溶液a的作用是将Ca(OH)2更多地转化为Ca(ClO)2,提高了钙原子利用率。
4.
(1) HCl 酸性
(2) 氧化 用一束光照射,出现一条光亮通路
(3)1ml
(4) MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O AC 17.4
【解析】
(1)
由图知,a物质为氯的氢化物、化学式为HCl,b为正七价氯的氧化物,能与水反应生成高氯酸,能与碱溶液反应生成高氯酸盐和水、则b属于酸性氧化物。
(2)
用ClO2消毒水时,ClO2还可将水中的Fe2+转化为Fe3+,则铁元素化合价升高被氧化,说明ClO2具有氧化性;胶体具有丁达尔效应,可以以此区分胶体和溶液,则检验有胶体生成的简便方法是:用一束光照射,出现一条光亮通路。
(3)
工业上可以用反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,制备ClO2,二氧化硫中硫元素从+4价升高到+6价、氯元素从+5价降低到+4价,则存在 ,若生成1mlClO2,则反应中转移电子的物质的量为1ml。
(4)
实验室可用二氧化锰与浓盐酸在加热反应生成MnCl2、Cl2和H2O,该反应的化学方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
①反应中,浓盐酸中部分氯元素从-1价升高到0价、部分氯元素化合价不变消耗氢离子,则浓盐酸在该反应中体现的性质有还原性和酸性;
选AC。
②若上述反应中每消耗1mlMnO2生成1ml Cl2,若产生0.2mlCl2,需消耗0.2ml MnO2、其质量为17.4g。
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液教学设计及反思: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液教学设计及反思,共2页。教案主要包含了化学(鲁科版)17等内容,欢迎下载使用。
化学第1节 水与水溶液教案及反思: 这是一份化学第1节 水与水溶液教案及反思,共2页。
高中化学鲁科版 (2019)选择性必修1第4节 离子反应教学设计及反思: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 离子反应教学设计及反思,共2页。