





中考化学总复习11节化合价化学式化学方程式化学反应基本类型和物质的变化与性质催化剂课件PPT
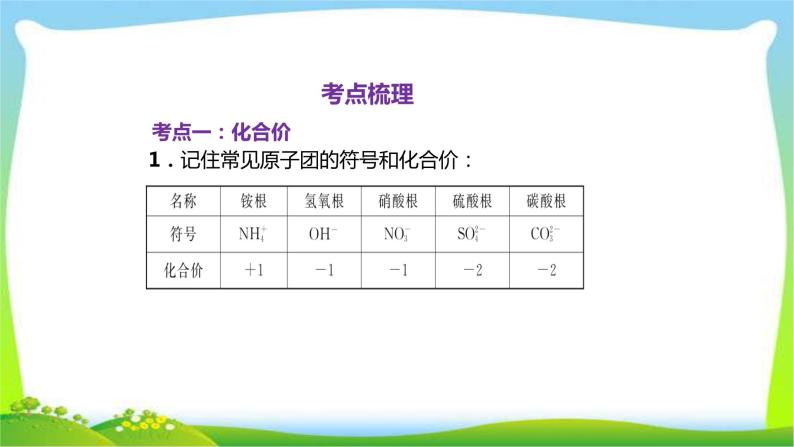
展开2.元素化合价的一般规律(1)在化合物中,氢元素通常显________价,氧元素通常显________价,金属元素通常显________价。(2)非金属与氢或金属化合时,非金属元素显________价;非金属与氧元素化合物时,非金属元素显________价。(3)在化合物中,正、负化合价的代数和为________。(4)在单质中,元素的化合价为________。(5)化合价的表示方法:①位置:标在元素符号的正上方;②书写顺序:先写正负,后写数值。
3.化合价的应用:①根据化合价求化合物的化学式;②根据化学式确定元素或根的化合价;③求原子个数:原子个数= 。
1.概念:用____ ____和________来表示物质组成的式子。2.书写方法:(1)单质的化学式:①金属单质、部分非金属单质(如硫、磷等)、稀有气体单质,由原子构成,其化学式直接用元素符号表示。如:铁________、铜________、碳________、硫________、氩气________、氦气________。②常温下是气态的非金属单质(双原子分子),在其元素符号右下角写上“2”,即表示其化学式。如:氢气________、氧气________、氮气________、氯气________。
(2)化合物的化学式:①某化某:氯化镁________、氯化铁________、氯化亚铁FeCl2、氧化铜________、氧化钙________、氧化铁________、氧化亚铁FeO。②某酸(酸):硫酸________、盐酸________、硝酸________、碳酸________、醋酸CH3COOH。③氢氧化某(碱):氢氧化钠________、氢氧化钙________、氢氧化铁________。④某酸某(盐):碳酸钠________、硫酸铜________、硝酸银________。
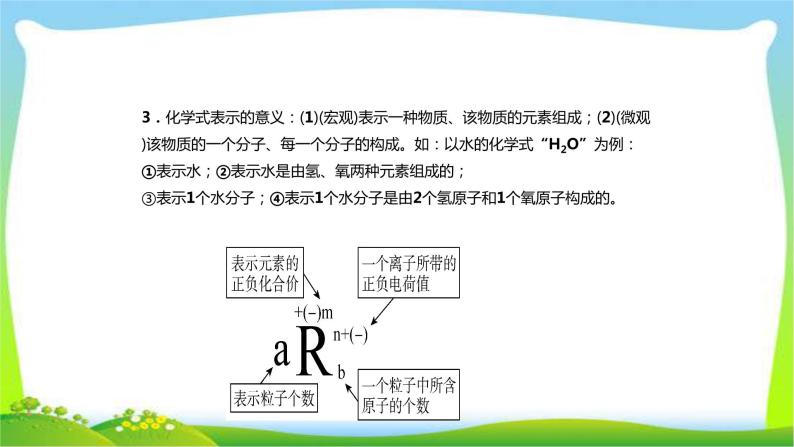
3.化学式表示的意义:(1)(宏观)表示一种物质、该物质的元素组成;(2)(微观)该物质的一个分子、每一个分子的构成。如:以水的化学式“H2O”为例:①表示水;②表示水是由氢、氧两种元素组成的;③表示1个水分子;④表示1个水分子是由2个氢原子和1个氧原子构成的。
画龙点睛:化学用语中各数字表示的意义a:表示有a个R粒子(原子、分子或离子等)。b:表示一个R粒子中含有b个原子。n:表示一个R离子带n个单位正(或负)电荷。m:表示(某化合物中)R元素的化合价为+(或-)m价。
1.化学方程式:用________来表示______ __的式子。2.化学方程式表示的意义:(以电解水2H2O2H2↑+O2↑为例)(1)宏观:①物质间的反应事实:表示水在通电条件下生成氢气和氧气;②反应物、生成物间的质量比:表示每36份质量的水在通电条件下生成4份质量的氢气和32份质量的氧气。(2)微观:反应物、生成物的粒子个数关系:表示每2个水分子在通电条件下生成2个氢分子和1个氧分子。
3.化学方程式书写的原则:书写时以_______ _为基础,遵循_______ _定律。(主要体现在等号两边原子的________和________相等)4.书写步骤:(1)写:等号左边写________,右边写________。(2)配:依据_______ _(方法:观察法、最小公倍数法和奇偶数法)来配平。(3)标:注明点燃、加热(△)、高温等反应条件;注明生成物,沉淀用“↓”,气体逸出用“↑”。(4)等:将短线改为等号。
温馨提示►对化学方程式的配平,若采用奇偶法,先把奇数变成偶数,一般先乘以2;若方程式中出现原子团,一般先配平原子团。
考点四:化学反应基本类型
1.化学反应的基本类型包括:_____ ___、 _____ ___ 、 _____ ___和_____ ___四大基本类型。
1.氧化反应:氧化反应是指物质与________的反应(物质与氧气反应一定是氧化反应,但氧化反应不一定是物质与氧气的反应)。(1)缓慢氧化:如食物腐败、金属生锈、酒和醋的酿造、动植物的呼吸。(2)剧烈氧化:物质的燃烧。2.还原反应:化合物中的________被夺走的反应。C+2CuO2Cu+CO2反应中:CuO中的________被C夺走生成了Cu,CuO发生了________反应,CuO是________剂,Cu是还原产物;C夺了CuO的氧生成了CO2,C发生了________反应,C是________剂,CO2是氧化产物。
3.中和反应:________作用生成盐和水的反应(属于复分解反应)。
温馨提示►化学反应的类型分两种情况,一是基本反应类型,二是其他反应类型;其中,中和反应是复分解反应的一种,有氧气参加的反应一定是氧化反应。
例题:下列化学符号中的数字表示的意义不正确的是( )A.2Na:“2”表示两个钠元素B.2OH-:“2”表示两个氢氧根离子C.O:“+2”表示镁元素的化合价为+2D.NO2:“2”表示一个二氧化氮分子含有两个氧原子
【易错点剖析】2Na中的2表示钠原子的个数为2个,元素只讲种类不讲个数,故A错误。
同类变式:化学用语是我们学习化学的重要工具,请作答:(1)2个氢原子________________;(2)n个亚铁离子______________;(3)硝酸铵的化学式______________;(4)H2O中数字“2”的意义____________ __;(5)写出构成氯化钠的微粒______________(用符号表示);(6)氧化铝中铝元素显+3价____________。
一个水分子中含有2个氢原子
考点梳理考点一:物质的变化与性质
1.物质的变化(1)物理变化:没有生成______ __的变化。如:____ ____。(2)化学变化:生成了________的变化。如:___ _____。(3)区别:变化时________________________________。(4)联系:在化学变化中________(填“一定”或“不一定”)伴随有物理变化,在物理变化中________(填“一定”或“不一定”)不伴随有化学变化。
2.物质的性质(1)物理性质:物质不需要在________变化中就表现出来的性质。如:________________________________________________________________________等。(2)化学性质:物质在化学变化中表现出来的性质。如物质的氧化性、可燃性、还原性、助燃性、稳定性、酸碱性等。(3)化学反应在生成新物质的同时,还伴随有________的变化。有的放出热量,如金属与酸的反应、______ 等。有的吸收热量,如氯酸钾分解、__________________ ______等。
颜色、状态、气味、熔点、沸点、硬度、密度、挥发性、溶解性
物质的燃烧、H2O2与MnO2反应
碳还原氧化铜、碳与二氧化碳的反应
3.性质和变化的区别:性质是物质本身特有的属性,物理性质不需要发生化学变化就表现出来;化学性质是在化学变化中表现出来的;而变化则是物质运动的过程。叙述物质的性质往往用“________”、“难”、“易”、“______”、“就”、“________”等表示能力或属性的用语。叙述物质的变化往往用“已经”、“了”等过去时或“在”等现在时等表示时态的用语。例:请判断下面情况属于物理变化,物理性质,化学变化还是化学性质。汽油可燃烧____________;汽油易挥发________________汽油在燃烧____________;汽油挥发了________________
温馨提示►①化学变化过程中通常伴随有发光、放热、变色、生成气体或沉淀等现象,但上述现象不能作为判断是否发生化学变化的依据。判断化学变化的依据是____________________。②化学反应中的能量转化包括:光能、热能、化学能、电能等之间的转化。
1.定义:催化剂是在化学反应中能改变其他物质的_____ ___,而本身的________和_______ _在反应前后都没有发生变化的物质。催化剂又叫触媒。 催化剂在化学反应中所起的作用叫催化作用。
温馨提示►①催化剂只能改变反应速率,而不能增加或减少生成物的质量;“改变”速率包括“加快”或“减慢”。②催化剂参加了反应,但一个化学反应没有催化剂并不意味着不能进行。③反应前后催化剂的质量和化学性质不改变,但物理性质可能改变。④二氧化锰≠催化剂。在某些反应中,二氧化锰是催化剂,但在某些反应中,二氧化锰可能是反应物或生成物。
2.要探究一种物质能否作为该反应的催化剂,必须符合三个条件:①能否改变反应速率;②在反应过程中本身的质量是否改变;(实验前后要称量)③在反应过程中本身的化学性质是否改变。(被探究的物质要进行二次实验)缺少上述任何一个实验结果都只能说该物质可能是催化剂。
例题:质量相等的两份药品a和b,a是混有少量二氧化锰的氯酸钾,b是纯净的氯酸钾,将药品分别加热,则收集到氧气的质量随反应时间变化的图像如下,其中正确的是( )
【易错点剖析】由二氧化锰作催化剂则可以加快其分解速度,则a反应快,时间短;因a为混有少量二氧化锰的固体氯酸钾,b为固体氯酸钾,且a和b的质量相等,则a中氯酸钾的质量小,则生成的氧气的质量小。
同类变式:下列图像不能正确反映对应的变化关系的是( )
【思路与技巧】红磷燃烧放出热量,集气瓶中压强先增大后减小。
中考一轮考点梳理复习-物质的变化与性质 化学反应类型课件PPT: 这是一份中考一轮考点梳理复习-物质的变化与性质 化学反应类型课件PPT,共41页。PPT课件主要包含了有其他物质生成,化学变化,MnO2,化合物,交换成分,其他反应类型,氧化铜,易错提示,化学性质,并列关系等内容,欢迎下载使用。
中考化学复习第5讲物质的变化和性质化学反应的类型课件: 这是一份中考化学复习第5讲物质的变化和性质化学反应的类型课件,共36页。PPT课件主要包含了化学反应的分类,知识梳理答案,没有生成生成,有气体或沉淀或水生成,放出吸收,空气小,洗洁精的乳化作用,氢气具有可燃性,的金属,合理即可等内容,欢迎下载使用。
初中化学中考复习 2020中考备考化学考点讲练课件 物质的变化和性质、基本反应类型: 这是一份初中化学中考复习 2020中考备考化学考点讲练课件 物质的变化和性质、基本反应类型,共14页。PPT课件主要包含了没有生成其他物质,生成其他物质,是否有其他物质生成,不需要发生化学变化,在化学变化中等内容,欢迎下载使用。