






苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度教课ppt课件
展开1、写出氯气与水反应的化学方程式2、氯气通入水可制得新制氯水,请分析新制氯水中的成分。
在常温下氯气能溶解于水,得到的氯水中既含有C12、H2O、HC1O分子,也含有H+、Cl-、C1O-、OH-等离子。这说明溶解的Cl2只有一部分与水发生了化学反应,它们的反应只能进行到一定的限度。同一条件下,C12与H2O能转变成HCl与HC1O,而HC1与HClO也能转变成C12与H2O。
在同一条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应
①正向反应和逆向反应同时进行。②一定条件下,反应物不可能全部转化为生成物,即反应物的转化率不可能达到100%。③可逆反应具有普遍性,大多数化学反应都是可逆反应。
2.FeCl3溶液与KI溶液的反应
溶液颜色由无色变为褐色
溶液分层,上层为浅绿色,下层油状液体呈紫色
2Fe3++2I-2Fe2++I2
在上述实验中,少量FeCl3溶液与过量KI溶液反应。从充分反应的溶液中分离出I2单质后,加入KSCN溶液仍然能检测到Fe3+的存在,说明Fe3+并未完全转化为Fe2+。由此可见,FeCl3和KI的反应没有完全进行到底,该反应有一定的限度。
(2)SO2与O2反应SO2与O2在一定条件下合成SO3的反应,也是可逆反应。
可逆反应在同一条件下既可以向正反应方向进行,同时又可以向逆反应方向进行,反应物不能完全转化为生成物,即可逆反应有一定的限度。
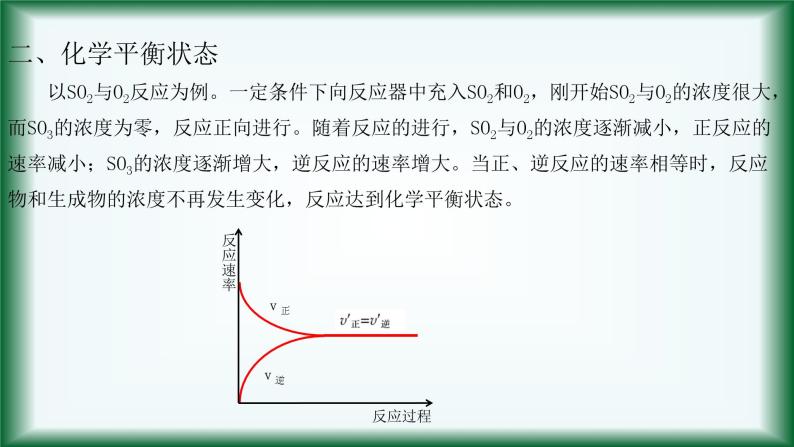
以SO2与O2反应为例。一定条件下向反应器中充入SO2和O2,刚开始SO2与O2的浓度很大,而SO3的浓度为零,反应正向进行。随着反应的进行,SO2与O2的浓度逐渐减小,正反应的速率减小;SO3的浓度逐渐增大,逆反应的速率增大。当正、逆反应的速率相等时,反应物和生成物的浓度不再发生变化,反应达到化学平衡状态。
可逆反应,在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,反应达到化学平衡状态,简称化学平衡。
2、化学平衡的建立过程
(1)从正反应开始建立平衡
(2)从逆反应开始建立平衡
化学平衡状态的建立与化学反应的途径无关,即化学平衡状态可以从正反应方向开始建立,也可以从逆反应方向开始建立。
3、化学平衡状态的特征:(1)等:v正_____v逆_____0;(2)动:化学平衡状态是一种_______平衡。达到平衡状态时,反应并没有停止,这时正反应和逆反应都依然在进行;(3)定:反应物的浓度和生成物的浓度__________;(4)变:外界条件(_______、_______、_______等)一旦改变,化学平衡状态就会被破坏,并在新的条件下建立新的化学平衡。
在高温、高压和催化剂存在条件下,氮气和氢气发生反应生成氨气。无论反应时间多长,在反应容器中总是同时存在氮气、氢气和氢气。请参考右图,描述从反应开始至平衡时各物质浓度的变化和正、逆反应速率的变化。
3、化学平衡状态的判断
温度、浓度、压强(有气体参加的反应)等
(2)化学平衡状态的标志
①v(正)=v(逆)>0。②反应物的浓度、生成物的浓度、各物质在总量中所占的百分比均不变。
①直接判据。ⅰ依据“v(正)=v(逆)>0”判断反应达到平衡状态。ⅱ体系中各组分的物质的量浓度或体积分数或物质的量分数保持不变。ⅲ对同一物质而言,单位时间内,断裂的化学键的物质的量与形成的化学键的物质的量相等。
ⅳ体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。
1、判断正误,正确的打“√”,错误的打“×”。(1)任何可逆反应都有一定的限度( )(2)化学反应达到限度时,正、逆反应速率相等( )(3)化学反应的限度与时间的长短无关( )(4)化学反应的限度是不可改变的( )
2、可逆反应达到平衡的重要特征是( )A.反应停止了B.正、逆反应的速率均为零C.正、逆反应都还在继续进行D.正、逆反应的速率相等且不等于零
3、对化学反应速率与化学反应限度的叙述,不正确的是( )A.当化学反应达到最大限度时反应速率为0B.同一化学反应,若反应条件不同,限度可能不同C.化学反应达到限度时,正逆反应速率相等D.化学反应的限度与时间的长短无关
化学第一单元 化学反应速率与反应限度优秀ppt课件: 这是一份化学第一单元 化学反应速率与反应限度优秀ppt课件,共56页。PPT课件主要包含了学习目标,知识体系,正反应,逆反应,进行到底,同时存在,知识梳理,碘单质,不能完全,反应物浓度最大等内容,欢迎下载使用。
苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度示范课ppt课件: 这是一份苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度示范课ppt课件,共24页。PPT课件主要包含了复习回顾,一可逆反应,有Fe3+剩余,有I2生成,溶液变棕色,溶液变为血红色,合作探究,交流与讨论,反应开始时,反应进行中等内容,欢迎下载使用。
苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度教学演示ppt课件: 这是一份苏教版 (2019)必修 第二册第一单元 化学反应速率与反应限度教学演示ppt课件,共18页。PPT课件主要包含了化学反应的限度,以氯气与水反应为例,有Fe3+剩余,有I2生成,溶液变棕色,溶液变为血红色,化学平衡的建立,C生↑v逆↑,tmin,化学平衡的标志等内容,欢迎下载使用。













