



第四章 物质结构 元素周期律【复习课件】-2020-2021学年高一化学单元复习一遍过(人教版2019必修第一册)
展开【考纲要求】1.了解原子的构成、元素原子核外电子排布规律和元素性质的关系;2.了解元素、核素和同位素的含义;3.了解元素周期表的结构,掌握元素周期律的实质,掌握元素的金属性和非金属性随原子序数的递增而呈现周期性变化的规律。4.了解元素周期表和元素周期律的应用5.了解离子键的定义和离子键的形成。了解离子化合物的概念,掌握常见离子化合物及离子电子式的书写。6.了解共价键的定义和共价键的形成。了解共价化合物的概念,掌握常见共价化合物及分子电子式的书写。7.了解分子间作用力和氢键及其对物质性质的影响。
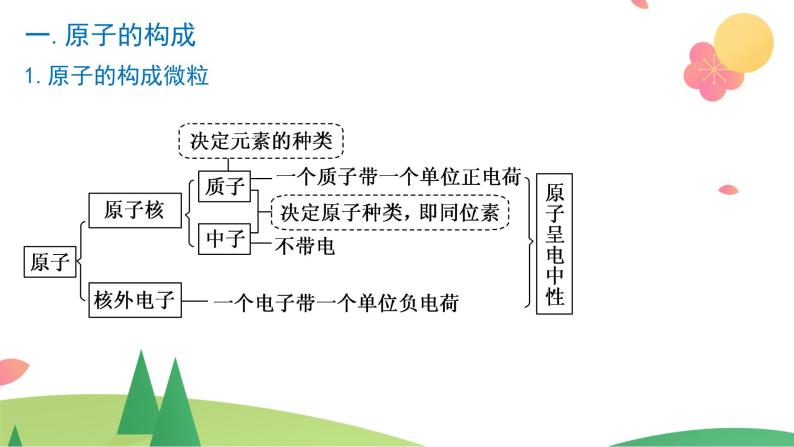
考点一:原子结构和元素周期表
考点三:元素周期表和元素周期律 的应用
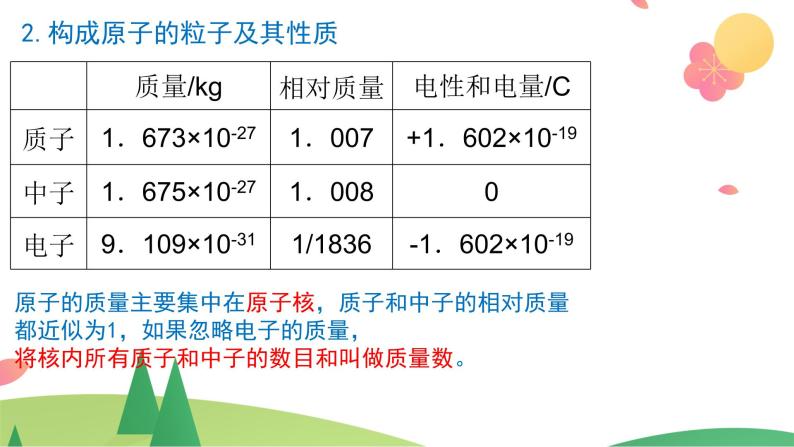
2.构成原子的粒子及其性质
原子的质量主要集中在原子核,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的数目和叫做质量数。
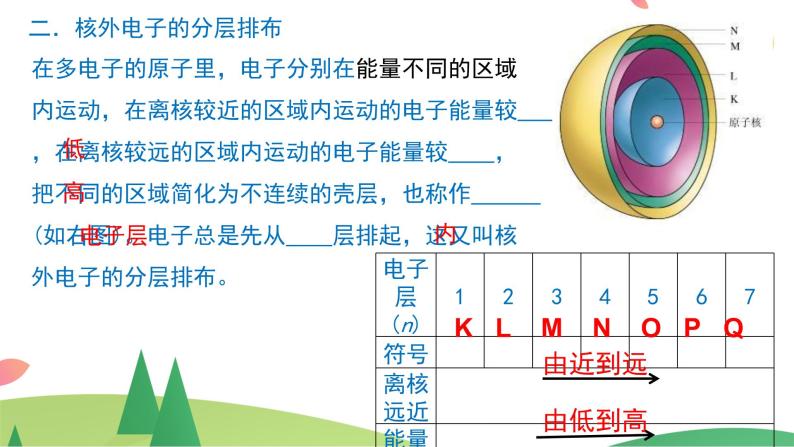
二.核外电子的分层排布
在多电子的原子里,电子分别在能量不同的区域内运动,在离核较近的区域内运动的电子能量较 ,在离核较远的区域内运动的电子能量较 ,把不同的区域简化为不连续的壳层,也称作 (如右图)。电子总是先从 层排起,这又叫核外电子的分层排布。
K L M N O P Q
1.核外电子排布的规律
(1)各电子层最多容纳 个电子;(2)最外层电子数不超过____个 (K层为最外层时不超过____个);(3)次外层电子数不超过____个;倒数第三层电子数不超过____个(4)核外电子总是尽先排布在能量 的电子层,然后由里向外,依次排布在能量逐步 的电子层。
以上四条规律相互联系和制约,如K原子为
因为尽管第三层最多可排2×32=18个,但作为最外层不能超过8个。
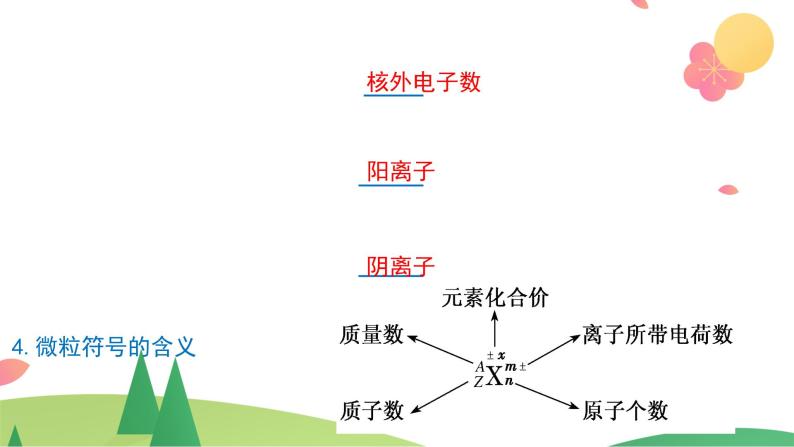
结构示意图包括原子结构示意图和离子结构示意图。(1)在原子结构示意图中,“圈”表示原子核及核内质子数,“弧”表示各电子层,弧线上的数字表示该电子层上的电子数,核内质子数与核外电子数相等。(2)在离子结构示意图中,核内质子数与核外电子数不相等。
3.核外电子排布与元素性质的关系
(1)金属元素原子的最外层电子数一般小于4,较易 电子,形成阳离子,表现出 性,在化合物中显正化合价。(2)非金属元素原子的最外层电子数一般大于或等于4,较易 电子,活泼非金属原子易形成阴离子,表现出 。在化合物中主要显负化合价。(3)稀有气体元素的原子最外层为 电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为 价。
三.元素周期表1.编排原则
原子序数=质子数=核电荷数=核外电子数
2.元素周期表的结构(1)周期(7个横行,7个周期)
共 7 个主族,包括短周期和长周期元素
共 7 个副族,只包括在长周期中
包括第8、9、10 纵行
七横七周期,三短和四长。
十八纵列十六族,七主七副零VIII三
①周期序数与电子层数的关系:周期序数=核外电子层数②主族序数与最外层电子数的关系:主族序数=最外层电子数
(1)同周期序数差规律A.短周期元素原子序数差=族序数差。B.两元素分布在过渡元素同侧时,原子序数差=族序数差。C.两元素分布在过渡元素两侧时,第四或五周期元素原子序数差=族序数差+10;第六周期元素原子序数差=族序数差+24。如第ⅡA族与第ⅢA族元素的原子序数之差,第四、五周期的都为11,第六周期为25。
(2)同主族元素的原子序数差的关系A.位于过渡元素左侧的主族元素,即第ⅠA族、第ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数。如钠、钾的原子序数之差为19-11=8(钠所在第三周期所含元素的种数)。B.位于过渡元素右侧的主族元素,即第ⅢA~第ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。如氯和溴的原子序数之差为35-17=18(溴所在第四周期所含元素的种数)。
ⅠA(除H外)称为碱金属元素 ⅡA称为碱土金属元素 ⅣA称为碳族元素 ⅤA称为氮族元素 ⅥA称为氧族元素 ⅦA称为卤族元素 副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
四.元素、核素、同位素
1.元素、核素、同位素的关系
2.同位素的特征①同一元素的各种核素的中子数不同,质子数相同,化学性质相同,物理性质有差异。②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.氢元素的三种核素1H:名称为氕,不含中子;2H:用字母D表示,名称为氘或重氢;3H:用字母T表示,名称为氚或超重氢。
4.几种核素的重要用途
原子的近似相对原子质量===质量数
(1)现行元素周期表已发现的元素有118种,由于同位素的存在,故核素的种数远大于118种。(2)不同核素可能具有相同的质子数,如 1H、2H;也可能具有相同的中子数,如 14C、16O;也可能具有相同的质量数,如14C、14N。(3)一种元素可以有多种核素,也可能只有一种核素。(4)同位素之间的转化,既不是物理变化也不是化学变化,是核反应。(5)同位素是指同一元素的不同“原子”间的关系,同素异形体是指同一元素的不同“单质”间的关系。(6)同位素之间可形成不同的同位素单质。如氢分子有六种:H2、D2、T2、HD、HT、DT。同位素之间可形成不同的同位素化合物。如水分子有:H2O(普通的水)、D2O(重水)、T2O(超重水)等。H、D、T与16O、17O、18O可形成3×6=18种水分子,相对分子质量不同。它们的物理性质(如密度)有所不同,但化学性质几乎完全相同。
1.已知某离子的结构示意图为 ,下列说法正确的是( )A.该元素位于第二周期ⅡA族B.该元素位于第二周期Ⅶ族C.该元素位于第三周期ⅡA族D.该元素位于第二周期0族【答案】C2.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( ) A.第二周期 B.第三周期 C.ⅣA族 D.ⅥA族
3.合成新物质是研究化学的主要目的之一。意大利科学家最近合成了一种新型的氧分子O4下列关于O4的说法中,正确的是( )A.O4是一种新型的化合物B.1个O4分子由两个O2分子构成C.O4和O2互为同素异形体D.O4和O2可通过氧化还原反应实现转化【答案】C
4.观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:(1)属于阴离子结构示意图的是________(填字母编号)。(2)性质最稳定的原子是_________(填字母编号)。(3)元素D的单质在B2中燃烧,该产物的化学式________。(4)在核电荷数1-18的元素内,列举一个与C原子的电子层结构相同的离子,写出离子的符号_________。(5)写出化合物DAB在水溶液中的电离方程式_____。
【答案】A C Na2O2 F-(Na+等合理均可) NaClO==Na++ClO-
金属元素的原子最外层电子一般少于4个,在化学反应中容易失去电子,具有金属性;非金属元素的原子最外层电子一般多于4个,在化学反应中容易得到电子,具有非金属性。
1.碱金属元素原子结构
原子结构相似性: 递变性:
最外层电子数相同,都为1个。
从上到下,随着核电核数的增大,电子层数增多,原子半径增大。
我们知道物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质是否完全相同?
相似性:最外层都只有一个电子,化学性质相似,很容易失去一个电子后呈+1价,活泼,有很强的还原性;递变性:从上到下,随着电子层数的增多,越来越容易失电子,还原性增强。
(1)与非金属的反应4Li + O2 Li2O 2Na + O2 Na2O2 K + O2 KO2K、Rb等碱金属与O2反应,会生成超氧化物。Rb、Cs在室温时,遇到空气会立即燃烧。(2)与水的反应2K + 2H2O = 2KOH + H2↑ 2Rb + 2H2O = 2KOH + H2↑
【总结】与Na、K类似,其他碱金属元素也都可以和水反应生成相应的碱和H2。从上到下,与氧气、水的反应越来越剧烈,甚至发生爆炸。碱金属与水反应:2M+2H2O = 2MOH+H2↑ 碱性: LiOH
相似性: 递变性:
最外层电子数相同,都为7个。
1.卤族元素的原子结构
2.卤族元素的化学性质
1、卤素单质与氢气的反应(见课本第8页)卤素和H2的反应可用通式H2+X2= ____来表示,反应时按F2、Cl2、Br2、I2的顺序,反应条件越来越____,反应程度越来越____,形成的卤化氢的稳定性也依次________。2、卤素单质间的置换反应:2NaBr+Cl2=2NaCl+Br2 氧化性:Cl2____Br2 还原性:Cl-____Br-2NaI+Cl2 =2NaCl+I2 氧化性:Cl2 ____I2 还原性:Cl-____I-2NaI+Br2 =2NaBr+I2 氧化性:Br2 ____I2 还原性:Br-____I-
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高(4)状态气态、液态、固态
3.卤族单质的物理性质
卤素单质随着原子核电荷数的递增,在物理性质和化学性质方面,均表现出一定的相似性和递变性。
【总结】同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐增大,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ;
2.随着卤素原子半径的增大,下列递变规律正确的是( )A.单质的熔沸点逐渐降低B.卤素离子的还原性逐渐增强C.气态氢化物的稳定性逐渐增强D.单质与氢气化合的能力逐渐增强【答案】B
1.下列关于碱金属的性质叙述正确的是( )A.单质均为银白色,密度均小于水B.单质与水反应时都能生成碱和氢气C.单质在空气中燃烧的生成物都是过氧化物D.单质的还原性逐渐减弱【答案】B
3.下列关于碱金属和卤素的说法,错误的是 ( )A.随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大B.碱金属元素中,锂原子失电子的力最弱,卤素中氟原子得电子能力最强C.钾与水的反应比钠与水的反应更剧烈D.溴单质与水反应比氯单质与水反应更剧烈【答案】D
4.下列说法正确的是( )A.Li在氧气中燃烧主要生成Li2O2B.At位于第七周期第ⅥA族,其气态氢化物的稳定性比HCl强C.卤族元素单质的熔、沸点随原子序数的增大而升高D.第二周期非金属元素的气态氢化物溶于水后所得溶液均呈酸性【答案】C
5.可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据元素周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子结构和性质的判断,错误的是( )①锂与水反应比钠剧烈 ②金属单质都可以密封保存在煤油中③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中显+1价⑦推测“类钫”单质的密度应该大于 ⑧“类钫”单质有较高的熔点A.①②④⑧B.①②③⑦C.③④⑤⑧D.①③④⑥
一.原子结构的周期性变化
1.最外层电子排布的周期性变化
规律:随着原子序数的递增,元素原子的最外层电子数呈现 的周期性变化(第一周期除外)。
2.原子半径的周期性变化
规律:随着原子序数的递增,元素原子的半径呈现 的周期性变化。
3.元素主要化合价的周期性变化 以1—18号元素为例
规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7(O、F除外),最低负化合价呈现-4→-1的周期性变化。
取决于原子最外层电子数的周期性变化
二.第三周期元素金属性和非金属性的变化
1. 钠、镁、铝的性质比较:
(1)第三周期元素性质变化规律: 从Na Cl ,金属性逐渐 ,非金属性逐渐 。(2)同周期元素性质递变规律:从左 右,金属性逐渐 ,非金属性逐渐 。
方法:元素金属性、非金属性强弱比较
(1)结构比较法最外层电子数 ,电子层数 ,元素金属性越强;最外层电子数 ,电子层数 ,元素非金属性越强。(2)位置比较法
1.不能作为判断硫、氯两种元素非金属性强弱的依据是( )A.单质氧化性的强弱B.单质沸点的高低C.单质与氢气化合的难易D.最高价氧化物对应的水化物酸性的强弱 【答案】B
2.下列事实不能用元素周期律解释的有( )A.碱性:KOH > NaOHB.相对原子质量:Ar > KC.酸性:HClO4 > H2SO4D.元素的金属性:Mg > Al【答案】B
3.下列关于元素金属性和非金属性强弱比较的说法不正确的是( )A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于CB.Si与H2化合所需温度远高于S与H2化合的温度,说明S的非金属性强于硅C.Na与冷水能发生反应,而Mg与冷水反应缓慢,说明Na的金属性强于MgD.石灰乳能溶于盐酸,Be(OH)2与盐酸和NaOH都能反应, 说明Ca的金属性强于Be【答案】A
4.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )A.简单离子半径:W<X<ZB.W与X形成的化合物溶于水后溶液呈碱性C.气态氢化物的热稳定性:W<YD.最高价氧化物的水化物的酸性:Y>Z【答案】B
5.用“>”或“<”回答下列问题①元素的非金属性越强,其对应最高价氧化物水化物的酸性越______;②元素的金属性越强,其对应最高价氧化物水化物的碱性越______;③元素的______性越强,其对应气态氢化物的稳定性越______;④酸性: ______ ;气态氢化物稳定性:H2S______HCl。
【答案】强 强 非金属 强 < <
化学键:使离子相结合或原子相结合的相互作用力。
一般形成于活泼金属(IA IIA)与非金属(VIA VIIA)之间
阴阳离子间通过静电作用力所形成的化学键
1.概念:阴、阳离子通过离子键结合而形成的化合物。 注意:(1)离子化合物中不一定含金属元素,如:NH4NO3是离子化合物,但全部由非金属元素组成。(2)含金属元素的化合物也不一定是离子化合物,如:AlCl3是共价化合物。(3)离子键只存在于离子化合物中,离子化合物中一定含离子键,也可能含共价键,如:NaOH、ZnSO4、Na2O2等。
2.离子化合物的特征:⑴具有较高的熔点和沸点,难挥发,常温下都是固体;⑵离子化合物硬而脆;⑶离子化合物固体不导电,熔化或溶于水后能导电。
3.常见离子化合物:⑴由活泼金属与活泼非金属形成的化合物 ⑵强碱一般是离子化合物⑶金属氧化物一般是离子化合物 ⑷盐一般都是离子化合物
非金属元素之间的成键情况?双方都不想失去电子。
我是非金属,我很少失电子
1.定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。2.成键微粒:原子3.成键本质:共用电子对4.成键条件:一般形成于两个非金属原子之间5.存在:共价键存在于非金属单质的多原子分子中,共价化合物和某些离子化合物中的离子团。
1.概念:原子之间通过共用电子对形成的化合物2.判断:只含有共价键的化合物属于共价化合物 (即若存在离子键,一定为离子化合物)3.常见物质类别:(1)非金属氧化物 (2)非金属氢化物 (3)酸 (4)绝大部分有机物
共价键中元素化合价的体现:形成非极性键的原子间共用电子对不偏移,不会产生化合价的升降;而形成极性键的过程中,电子对偏离的元素化合价升高,电子对偏向的元素化合价降低。
在元素符号周围用小黑点 · (或×)来表示原子的最外层电子。这种式子叫做电子式。
Na× ×Mg× • Cl • O •
注意:一个小黑点(·)或x代表一个电子,小黑点(·)或x的个数即原子的最外层电子数。
①简单阳离子还用离子符号表示:如:Na+、Al3+、Ca2+等;②阴离子和复杂的阳离子(如:NH4+)要加括号,并注明所带电荷数。如: 、 、 、 等。
阳离子电子式和阴离子电子式组合成离子化合物的电子式。书写时应注意,相同的离子不能写在一起,一般对称排布。如:MgF2的电子式为
4.共价分子电子式用电子式表示共价化合物时,不需要加“[ ]”和标电荷。如:Cl2的电子式为 ,HCl的电子式为 ,N2的电子式为 ,CO2的电子式为 。
5.用电子式表示化合物形成过程
用电子式表示化合物的形成过程,应注意以下几点:⑴反应物要用原子的电子式表示,而不能用分子式或分子的电子式表示。当反应物中有“同类项”时,可分写也可合写;但生成物中的“同类项”只能分写,不能合写。⑵表示电子转移情况的曲线箭头可标,也可不标。⑶也要符合质量守恒定律。但用“→”连接而不能“=”。⑷不写反应条件。用电子式表示氯化钠的形成过程:
6.结构式在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如:
【总结】判断电子式是否正确应注意以下几点:①每个原子周围是否满足了8电子稳定结构(H为2电子稳定结构)共价化合物中8电子稳定结构的判断规律ⅰ.对原子序数不大于5的元素,形成化合物时,一般不可能为8电子稳定结构。如HCl中的H,BeCl2中的Be,BF3中的B等。ⅱ.对原子序数大于5的元素,形成化合物时,若|元素化合价|+原子最外层电子数=8,则该化合物中该元素满足8电子稳定结构;否则不满足。如CO2中的C:|+4|+4=8,满足,O:|-2|+6=8,也满足;PCl5中的P:|+5|+5=10≠8,不满足,Cl:|-1|+7=8,满足。ⅲ。对于共价单质,方法与上面类似,只是将“|元素的化合价|”换成共用电子对数即可。②所标的电子总数是否等于所有原子的最外层电子数之和。
六.化学键与化学反应的实质
1.化学键:使离子相结合或原子相结合的作用力。2.化学反应的实质:化学反应的实质是旧化学键的断裂和新化学键的形成。
注意:①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的断裂,不一定是化学变化,如熔融NaCl。②物质中不一定都存在化学键,如He等稀有气体分子。③非金属元素的两个原子之间能形成共价键,但多个非金属元素原子间也可能形成离子键,如NH4Cl。
六.分子间作用力和氢键
冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。
1.下列说法不正确的是( )A.凡金属元素跟非金属元素化合时都能形成离子键B.原子间先通过得失电子变成阴阳离子后,阴阳离子间才能形成离子键C.具有强得电子能力的原子与具有强失电子能力的原子相遇时能形成离子键D.一般情况下,活泼金属(第Ⅰ A、Ⅱ A族金属)和活泼的非金属(第Ⅵ A、Ⅶ A族非金属)之间化合时,易形成离子键【答案】A
2.关于共价键的说法正确的是 ( )A.金属原子在化学反应中只能失去电子,因而不能形成共价键B.由共价键形成的分子可以是单质分子,也可以是化合物分子C.共价键只能在不同原子之间形成D.稀有气体分子中只存在共价键 【答案】B
3.下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )A.氧分子:O=O B.S2Cl2:Cl-S-S-ClC.氢氰酸:H-C N D.光气(COCl2):Cl-C-O-Cl【答案】D
4.书写下列物质电子式①Cl2:_______________; ②CO2:_______________; ③NaOH:_______________;④Na2S:_______________; ⑤H2O2:_______________;
5. 用电子式表示下列化合物的形成过程NaF:CaCl2:Na2S: MgO:K2O:
6.用电子式表示下列化合物的形成过程CO2 : H2O: NH3 : HCl:
人教版 (2019)必修 第一册第二节 元素周期律评优课复习课件ppt: 这是一份人教版 (2019)必修 第一册第二节 元素周期律评优课复习课件ppt,共19页。PPT课件主要包含了原子结构,元素周期表,元素周期律,化学键,第五周期ⅦA族等内容,欢迎下载使用。
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教课内容ppt课件: 这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律教课内容ppt课件,共60页。PPT课件主要包含了第二节元素周期律,自读教材,要点归纳,题组训练等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 元素周期律复习ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律复习ppt课件,共60页。PPT课件主要包含了考点二元素的性质,考点四化学键,知识复习,题点呈现等内容,欢迎下载使用。












