

高考一轮复习第3讲:物质的量浓度与溶液配置
展开知识介绍
一定物质的量浓度溶液的配制
1.物质的量浓度定义
用来表示单位体积溶液里所含溶质B的物质的量的物理量,叫做溶质B的物质的量浓度,符号为cB,单位为ml/L(或ml·L−1)。
2.物质的量(nB)、物质的量浓度(cB)与溶液体积(V)之间的关系
物质的量浓度(cB)=,即。
(1)溶质是溶液中的溶质,可以指化合物,也可以指离子或其他特殊的组合。
分析溶质时要注意特殊情况下的溶液的溶质,如NH3溶于水后所得氨水的溶质为NH3·H2O,但习惯上认为氨水的溶质为NH3;SO3溶于水后所得溶液的溶质为H2SO4;CuSO4·5H2O 溶于水后所得溶液的溶质为CuSO4。
(2)体积V指溶液的体积而不是溶剂的体积。
3.一定物质的量浓度溶液的配制
(1)主要仪器
容量瓶(一定容积)、托盘天平(砝码)、烧杯、量筒、玻璃棒、胶头滴管等。
容量瓶的构造
注意事项
①不能配制任意体积的溶液。选择容量瓶时遵循“大而近”的原则,所需溶质的量按所选用的容量瓶的规格进行计算。
②不能将固体或浓溶液直接在容量瓶中溶解或稀释。
③不能作为反应器或用来长期贮存溶液。
④不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定。
⑤向容量瓶中注入液体时,要用玻璃棒引流;且玻璃棒下端要靠在容量瓶的刻度线以下的瓶颈壁上。
(2)配制步骤
①过程示意图
②配制步骤
以配制500 mL 1.00 ml·L-1 NaOH溶液为例
二、配制一定物质的量浓度溶液的误差分析
1.误差分析的依据
若V不变,分析n的变化;若n不变,分析V的变化。
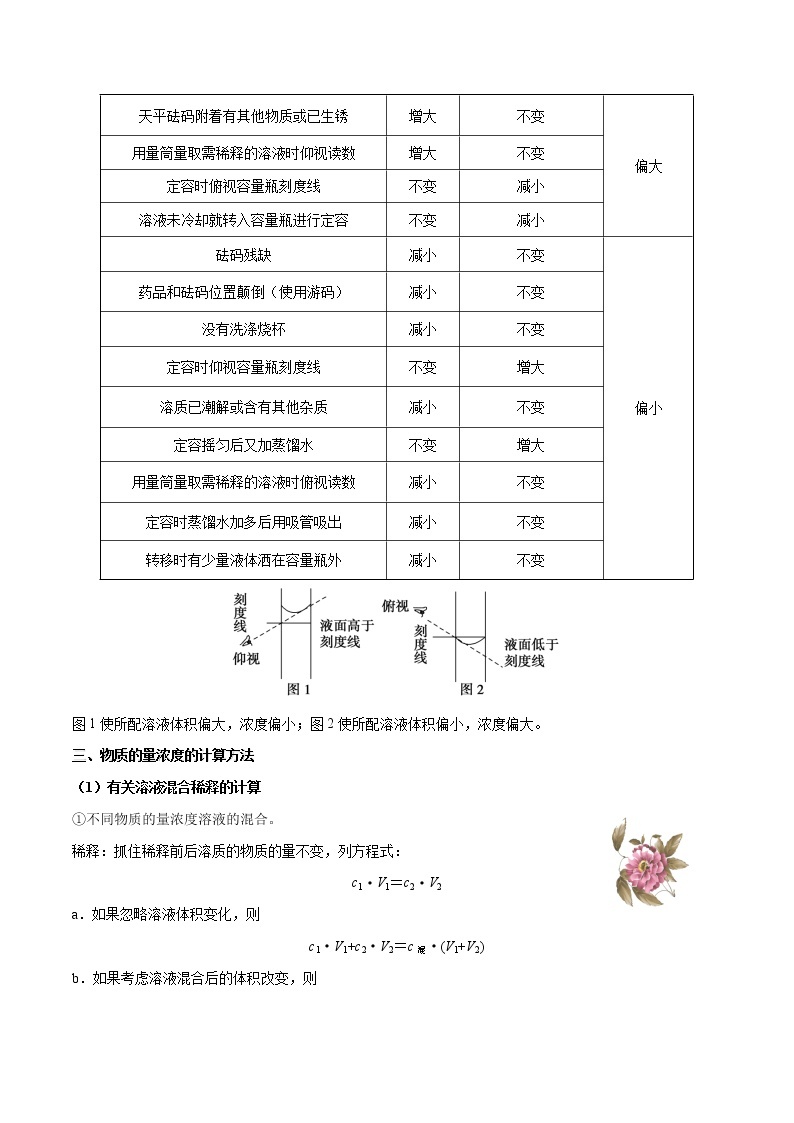
2.常见的实验误差分析
图1使所配溶液体积偏大,浓度偏小;图2使所配溶液体积偏小,浓度偏大。
三、物质的量浓度的计算方法
(1)有关溶液混合稀释的计算
①不同物质的量浓度溶液的混合。
稀释:抓住稀释前后溶质的物质的量不变,列方程式:
c1·V1=c2·V2
a.如果忽略溶液体积变化,则
c1·V1+c2·V2=c混·(V1+V2)
b.如果考虑溶液混合后的体积改变,则
c1·V1+c2·V2=c混·V混(V混=)
②不同质量分数的两种溶液混合的计算。
混合:抓住混合前后溶质的质量不变,列方程式:
m1·ω1+m2·ω2=(m1+m2)·ω混
③两种同溶质溶液等质量混合、等体积混合时质量分数的判定。
a.等质量混合:两种同溶质液体(或某溶液与水)等质量混合时,ω混=。
b.等体积混合:两种同溶质液体(或某溶液与水)等体积混合时,
当ρ液>1时,ω混>。
当ρ液<1时,ω混<。
(2)物质的量浓度、溶解度、质量分数的相互换算
①溶质的质量分数ω与物质的量浓度c:
c====(密度的单位为g·cm−3或g·mL−1)
②饱和溶液溶质的质量分数与溶解度:
ω=×100%,c=
③标准状况下气体溶解于水后所得溶液的物质的量浓度
c=
式中V为标准状况下气体的体积(单位为L),V(H2O)为水的体积(单位为L,ρ水=1 g·mL−1),ρ为溶液的密度(单位为g·cm−3或g·mL−1),M为气体摩尔质量(单位为g·ml−1)。
探讨分析
1.实验室需要用到480 mL 0.1 ml·L-1Na2CO3溶液,根据溶液配制方法回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体______g。
(2)用托盘天平和小烧杯称量碳酸钠晶体的质量,其正确操作顺序的标号为________(同一步骤可用多次)。
A.调整零点 B.将游码移至刻度尺的零刻度处 C.将碳酸钠晶体放入小烧杯中称量 D.称量空的小烧杯 E.将砝码放回砝码盒内 F.记录称量的结果
(3)若实验遇到下列情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
①称量时Na2CO3晶体放置右盘________。
②定容时仰视刻度线________。
【解析】(1)需要480 mL溶液,配制时需要用500 mL容量瓶,配制500 mL 0.1 ml·L-1Na2CO3溶液,所需m(Na2CO3·10H2O)=286 g·ml-1×0.5 L×0.1 ml·L-1=14.3 g。(2)用天平称量药品时,应先将游码移到零刻度处,调节螺母使天平平衡;先称量小烧杯质量;记录称量结果;然后放入晶体称量其质量;记录称量结果;将砝码放回砝码盒中,将游码移至零刻度,结束称量。(3)①物质放置右盘,所称物质偏少。②所配溶液体积偏大。
【答案】D
2.下列关于0.2 ml·L−1K2SO4溶液的正确说法是
A.该溶液中所含K+、SO42−总数为0.6NA
B.500 mL该溶液中含有0.1NA个K+
C.任意体积的该溶液中,K+浓度均是0.4 ml·L−1
D.2 L该溶液中SO42−浓度是0.4 ml·L−1
【答案】C
【解析】A、因为n=cV,选项中不知道溶液的体积,无法计算出离子的物质的量,A错误。B、K+的浓度为0.4 ml·L−1,所以K+的物质的量n=0.5 L×0.4 ml·L−1=0.2 ml,即含有0.2NA个K+,B错误。C、溶液的浓度一旦确定,则溶液的浓度与所取溶液的体积无关,所以任意体积的该溶液中K+浓度均是0.4 ml·L−1,C正确。D 、溶液的浓度一旦确定,则溶液的浓度与所取溶液的体积无关,所以SO42−浓度仍是0.4 ml·L−1,D错误。正确答案为C。
3.下列关于物质的量浓度表述正确的是
A.0.3 ml·L-1的Na2SO4溶液中含有Na+和的总物质的量为0.9 ml
B.在K2SO4和NaCl的中性混合水溶液中,如果Na+和的物质的量相等,则K+和Cl-的物质的量浓度一定相同
C.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 ml·L-1,只有当22.4 L(标准状况)氨气溶于水制得1 L氨水时,其浓度才是1 ml·L-1
D.10 ℃时,100 mL 0.35 ml·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度大于0.35 ml·L-1
【解析】0.3 ml·L-1的Na2SO4溶液中Na+、的物质的量浓度为0.6 ml·L-1、0.3 ml·L-1,由于缺少溶液的体积,所以无法计算出离子的物质的量,故A错误;在K2SO4和NaCl的中性混合水溶液中存在:c(Na+)+c(K+)=c(Cl-)+2c(),Na+和的物质的量相等,即物质的量浓度相等,所以K+和Cl-的物质的量浓度一定不相同,故B错误;溶液的体积不等于溶剂的体积,所以1 L水吸收22.4 L氨气时所得氨水的浓度不是1 ml·L-1;标准状况下22.4 L氨气的物质的量为1 ml,溶于水制得1 L氨水时,其浓度一定等于1 ml·L-1,故C正确;10 ℃时,0.35 ml·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,溶液仍然是该温度下的饱和溶液,溶质的物质的量浓度不变,仍为0.35 ml·L-1,故D错误。
【答案】C
好题精做
1.在配制250 mL 2.0 ml/L NaCl溶液的实验中,必须使用的仪器是
2.称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 ml NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
A.1:1 B.1:2 C.1.87:1 D.3.65:1
3.1 L 0.1 ml/L K2CO3溶液中含有的K+的数目为
A.0.1 B.0.2 C.6.02×1023 D.1.204×1023
4.某同学用Na2CO3配制0.10 ml/L Na2CO3溶液的过程如图所示。你认为该同学的错误有
A.①⑤⑥ B.②④⑦ C.①⑥⑦ D.⑤⑥⑦
5.在配制溶液过程中正确的是
A.配制盐酸溶液用量筒量取盐酸时量筒必须先润洗
B.配制盐酸溶液时,容量瓶中少量的水不影响最终的浓度
C.定容时观察液面俯视会造成所配溶液浓度偏低
D.浓H2SO4稀释后即可注入容量瓶配制
6.(双选)配制一定物质的量浓度的盐酸时,下列操作可使所配制溶液浓度偏高的是
A.用量筒量取浓盐酸时仰视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
7.在标准状况下,将V L HCl气体溶于水制得1000 mL盐酸,则该盐酸的物质的量浓度为
A. ml/L B.ml/L
C. ml/L D. ml/L
8.1 L K2SO4和MgSO4的混合溶液中,含Mg2+ 2.4 g,的物质的量浓度为1 ml/L,则MgSO4和K2SO4的物质的量浓度分别是________、________。
9.NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.2.4g镁在足量的O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6 L CO2气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1 L 0.5 ml/L CH3COOH溶液中含有的H+数为0.05NA
10.实验室欲用NaOH固体配制1.0 ml·L−1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为____________ g,要完成本实验该同学应称出____________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
参考答案
1.【答案】A
【解析】配制一定物质的量浓度溶液的实验时,必须使用的仪器是容量瓶。
2.【答案】C
【解析】利用极值法分析,可知0.1ml氢氧化钠不足,故先将NH4HSO4反应完,再反应(NH4)2SO4,因共生成NH30.08ml,故与H+反应的氢氧化钠为0.02ml,则可知道NH4HSO4为0.02ml,则(NH4)2SO4质量为7.24g-115g/ml×0.02ml=4.94g,(NH4)2SO4的物质的量为4.94g ÷132g/ml=0.0374ml。因此(NH4)2SO4与NH4HSO4物质的量之比为:1.87:1 ,故选C。
3.【答案】D
【解析】n(K2CO3)=c(K2CO3)×V=0.1 ml/L×1 L=0.1 ml,根据1K2CO3~2K+,可知n(K+)=0.2 ml,所以N(K+)= n(K+)×NA=6.02×1023 ml−1×0.2 ml=1.204×1023,故选D。
4.【答案】C
【解析】称量Na2CO3固体时,应将被称量物放在托盘天平的左盘,砝码放在右盘,①错误;定容时,视线应与凹液面最底处相切,⑥错误;摇匀时,应将容量瓶反复上下颠倒,⑦错误,故C项正确。
5.【答案】B
【解析】A、量筒量取溶液时不应润洗,否则所取溶液偏多,选项A错误;B、因配制过程中需要用蒸馏水定容,故配制盐酸溶液时,容量瓶中少量的水不影响最终的浓度,选项B正确;C、定容时观察液面俯视,则所加蒸馏水偏少,会造成所配溶液浓度偏高,选项C错误;D、浓H2SO4稀释后必须冷却至室温再注入容量瓶配制,选项D错误。答案选B。
6.【答案】AC
【解析】A项,用量筒量取浓盐酸时仰视读数使得所取浓盐酸多了,导致所配溶液浓度偏高。B项,搅拌时有液体飞溅, 说明有盐酸损失,导致浓度偏低。C项,定容时俯视容量瓶瓶颈刻度线,说明定容时水加少了,导致浓度偏高。D项,定容后再加水,水加多了,导致浓度偏低。
7.【答案】C
【解析】在标准状况下,将V L HCl气体溶于水制得1000 mL盐酸,氯化氢的物质的量是,所以该盐酸的物质的量浓度为,答案选C。
8.【答案】0.1 ml/L 0.9 ml/L
【解析】n(Mg2+)==0.1 ml,则c(MgSO4)==0.1 ml/L,MgSO4提供的c()=0.1 ml/L,则K2SO4提供的c()=1 ml/L−0.1 ml/L=0.9 ml/L,所以c(K2SO4)=0.9 ml/L。
9.【答案】B
【解析】A、2.4g镁的物质的量为0.1ml,而镁在氧气中反应后变为+2价,故0.1ml镁转移0.2NA个电子,故A错误;B、标况下5.6L二氧化碳的物质的量为0.25ml,而二氧化碳中含2个氧原子,故0.25ml二氧化碳中含0.5NA个氧原子,故B正确;C、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故C错误;D、醋酸是弱电解质,不能完全电离,故溶液中的氢离子的个数小于0.05NA个,故D错误.故选B
10.【答案】(1)②①③⑧⑤⑥⑦④ 250 mL容量瓶
(2)27.4 10.0
(3)查漏
(4)④⑤
【解析】(1)配制溶液的几个步骤为:②计算→①称量→③溶解→⑧冷却→⑤转移→⑥洗涤→⑦定容→④摇匀。主要仪器为250 mL容量瓶。
(2)配制240 mL溶液,需使用250 mL容量瓶,计算时按250 mL计算,n(NaOH)=1.0 ml·L−1×0.25 L=0.25 ml,m(NaOH)=10.0 g。称量时应左物右码,图中左码右物,因有质量关系:游码+右盘=左盘,故烧杯的质量为30 g−2.6 g=27.4 g。
(3)容量瓶必须查漏后,才能使用。
(4)①没洗涤会减少溶质,引起浓度偏低;②溶液洒到外面,引起浓度偏低;③含少量蒸馏水,对溶液浓度没有影响;④俯视刻度线,导致液面不到刻度线,引起浓度偏高;⑤未冷却就转移,定容并冷却后,液体体积减少,浓度偏高;⑥定容后再加水,溶液体积变大,溶液浓度偏低。
可能引起误差的操作
因变量
c/ml·L−1
n/ml
V/L
天平砝码附着有其他物质或已生锈
增大
不变
偏大
用量筒量取需稀释的溶液时仰视读数
增大
不变
定容时俯视容量瓶刻度线
不变
减小
溶液未冷却就转入容量瓶进行定容
不变
减小
砝码残缺
减小
不变
偏小
药品和砝码位置颠倒(使用游码)
减小
不变
没有洗涤烧杯
减小
不变
定容时仰视容量瓶刻度线
不变
增大
溶质已潮解或含有其他杂质
减小
不变
定容摇匀后又加蒸馏水
不变
增大
用量筒量取需稀释的溶液时俯视读数
减小
不变
定容时蒸馏水加多后用吸管吸出
减小
不变
转移时有少量液体洒在容量瓶外
减小
不变
2024届高考化学一轮复习专题1第3讲物质的量浓度及溶液的配制基础学案: 这是一份2024届高考化学一轮复习专题1第3讲物质的量浓度及溶液的配制基础学案,共34页。
2024届高考化学一轮复习专题1第3讲物质的量浓度及溶液的配制基础学案: 这是一份2024届高考化学一轮复习专题1第3讲物质的量浓度及溶液的配制基础学案,共34页。
鲁科版高考化学一轮复习第1章第2讲物质的量浓度及溶液的配制教学课时学案: 这是一份鲁科版高考化学一轮复习第1章第2讲物质的量浓度及溶液的配制教学课时学案,共27页。












