




高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用教学课件ppt
展开1.什么叫离子键?
使阴、阳离子结合成化合物的静电作用,叫做离子键。
活泼的金属和活泼的非金属之间;
大部分的碱、盐、金属氧化物、金属过氧化物.
在元素符号周围用小黑点或来表示原子的最外层电子的式子。
2.离子键成键的特点:
复习上节所学过的主要内容
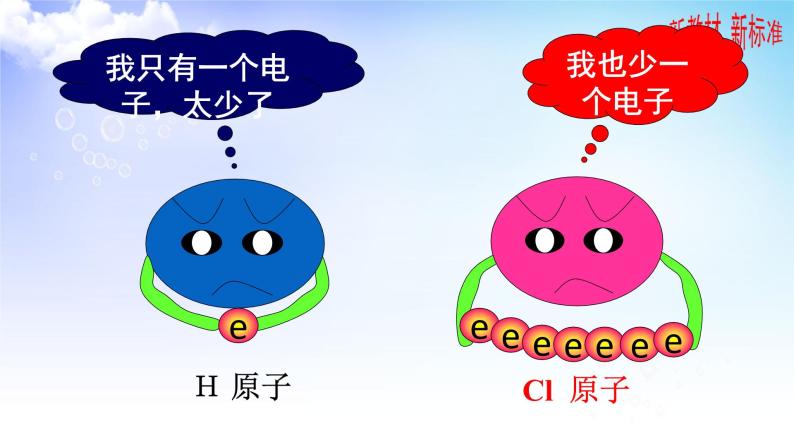
活泼的金属元素和活泼非金属元素化合时形成离子键,非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向。
非金属元素的原子间可通过共用电子对的方法使双方最外电子层均达到稳定结构。
我只有一个电子,太少了
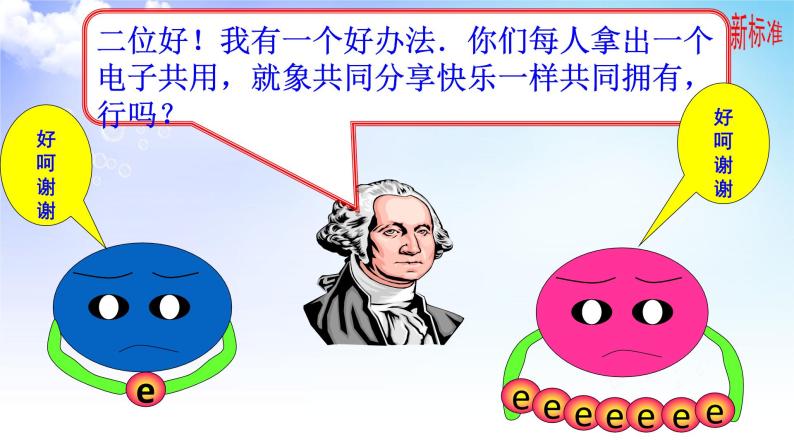
二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有,行吗?
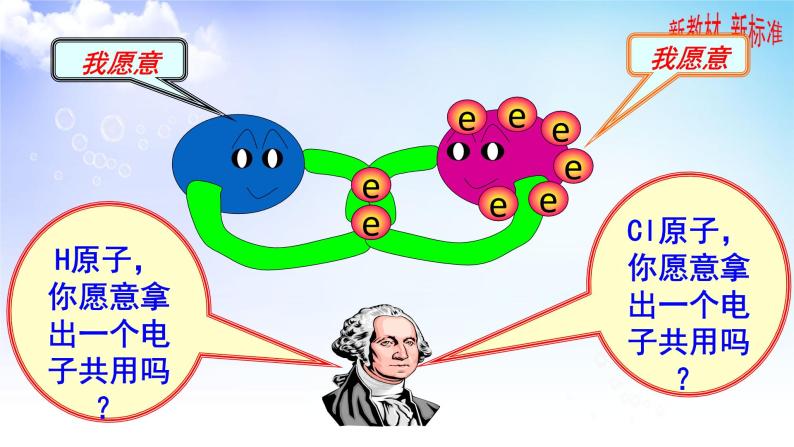
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
★氢气分子的形成:
共用电子对不偏移,成键原子不显电性
共用电子对偏向氯原子,氯原子带部份负电荷,氢原子带部份正电荷。
原子之间通过共用电子对所形成的相互作用,叫做共价键。
定义: 原子间通过共用电子对所形成的化学键叫做共价键。
含有共价键的化合物不一定是共价化合物
只有共价键的化合物才是共价化合物
同种或不同种非金属元素
成键元素 是否相同:
非极性(共价)键——A-A键
极性(共价)键——A-B键
(2) 共用电子 对数目:
结构式:用一条短线来表示原子间的一对共用电子对,省略其余的电子.
5.用电子式表示共价分子书写要求:
1.每个原子均应达到稳定(一般为8电子)的结构
2.不能加中括号[ ],不能标正负电荷数
3. 在用电子式表示共价分子时,首先需分析所涉及的原子最外层有几个电子,则这个原子所需要的共用电子对数即为8-n(氢只需共用一对)
CH4 NH3 HClO
用电子式表示下列共价分子的形成过程
注意事项: ①不用箭头表示电子的偏移; ②在共价分子中相同原子不能合并在一起; ③没有形成离子。
根据共价键的成因,共价键的强弱取决于成键原子的半径大小,原子的半径越小,共价键越强。如:比较金刚石和晶体硅,H2O和H2S
氢氧化钠晶体中,钠离子与氢氧根离子以离子键结合;在氢氧根离子中,氢与氧以共价键结合。请用电子式表示氢氧化钠。
[ ]
过氧化钠晶体中,过氧根离子 (O2 2-) 与钠离子以离子键结合;在过氧根离子中,两个氧原子以共价键结合。请用电子式表示过氧化钠。
离子化合物和共价化合物的判断
凡有离子键的化合物一定是离子化合物如: NaCl 、CaCl2、 NaOH 、NH4Cl只有共价键的化合物才是共价化合物如: HCl 、 H2O 、 CO2 、 NH3
HF N2 CO2 Ba(OH)2 Na2O2 HClO H2S NaBrNH4Cl CH4 Br2 CCl4 HI K2S
1.分清键型(是离子键还是共价键)
2.形成离子键时,要标电荷; 形成共价键时,不标电荷
3.成键后的原子或离子,一般为8电子(或2电子)稳定结构
6. 碳原子形成的共价键的特点:
碳的化合物种类和数目繁多的原因(1)碳原子最外层有 4 个电子,既难得电子又难失电子,一个碳原子可以和其他原子形成 4 个共价键。(2)碳原子之间可以通过一对、两对或三对共用电子对相结合,分别构成碳碳单键C-C,碳碳双键 C=C ,或碳碳三键C≡C ;(3)碳原子之间可以通过共价键彼此结合形成 碳链 ,也可以连接形成 碳环 。
两个步骤:1.旧化学键的断裂;2.新化学键的形成.
共 价 键
离 子 键
原 子
活泼金属(包括铵离子)与活泼非金属化合
两种相同或不同非金属原子化合
1.分子间作用力(1)概念分子间存在着将分子 的作用力,叫作分子间作用力。(2)特点①分子间作用力比化学键 得多。②分子间作用力是影响物质 和 的重要因素之一。
2.氢键(1)像H2O、NH3、HF这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫氢键。(2)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。(3)分子间形成的氢键会使物质的熔点和沸点升高,对物质的溶解度有影响,如NH3极易溶于水,主要是氨分子与水分子之间易形成氢键。
同种非金属元素原子之间形成非极性共价键(非极性键)
共价键既存在于非金属单质和共价化合物中,也存在于多原子的离子化合物中。
用电子式表示共价分子时,不标 [ ] 和电荷数。
原子间通过共用电子对所形成的化学键叫做共价键。
不同种非金属元素原子之间形成极性共价键(极性键)
相邻原子之间强烈的相互作用叫化学键.
含离子键的物质:含共价键的物质:
离子化合物:共价化合物:
2.下列说法中正确的是 ( )(A)含有共价键的分子一定是共价分子(B)只含有共价键的物质一定是共价化合物(C)离子化合物中可能含有共价键和离子键(D)氦分子中含有共价键
也可能是单质分子,如氯气,氮气。
氦气是单原子分子,不存在化学键。
也可能是离子化合物,如 NaOH, Na2O2 。
3、写出下列物质的电子式,并指出化合物的类型
H2O HClO
NaOH
4.下列是中学化学常见的物质A.HCl B.NaCl C.Na2SO4 D.Na2S E.He F.N2(1)这些物质中只含共价键的是 。(2)既含离子键又含共价键的是 。(3)试写出D、F的电子式、F的结构式 、 、 。
必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用优质课ppt课件: 这是一份必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用优质课ppt课件,共60页。PPT课件主要包含了学习目标,必备知识·自主学习,共用电子对,成稳定的电子层结构,N≡N,HC≡CH,将分子聚集在一起,沸点和溶解性,关键能力·合作学习,提示HC≡N等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用图片课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用图片课件ppt,共36页。
高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用课文内容课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用课文内容课件ppt,共35页。PPT课件主要包含了学业基础,共用电子对,共价键,不易失去,不易得到,碳碳单键,碳碳双键,碳碳三键,弱得多,分子间作用力等内容,欢迎下载使用。













